
【题目】化学与生产、生活及社会可持续发展密切相关,下列说法不正确的是
A.将地沟油回收加工成燃料,可提高资源的利用率
B.扩大铅蓄电池、汞锌锰等含重金属元素的干电池的生产,满足消费需求
C.推广使用聚碳酸酯等可降解塑料,可减少白色污染
D.化石燃料的蕴藏量有限且不可再生,最终将会枯竭
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期元素主族,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。
(1)写出X2Z2的电子式_________,Y单质分子的结构式____________。
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的分子式是_____________。
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子,阳离子_____阴离子______。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4∶2∶3,该盐的化学式是_____。X、Y也能形成一种盐,X、Y元素的原子个数比为5∶1,则该盐的化学式为 ______________________________
(5)下列说法正确的是(____)
a.氢化物热稳定性:Y>Z
b.氢化物的熔沸点:Y>Z
c.原子半径:Y>Z
d.Z的氢化物的熔沸点比同主族其他物质的高,是因为分子内形成了氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列说法正确的是( )
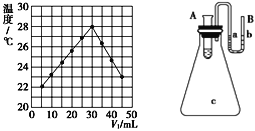
图1 图2
A. 据图1可知实验时的环境温度等于22 ℃。
B. 据图1可知该NaOH溶液的物质的量浓度为3.0molL-1
C. 图2,如果在装有水的小试管中分别加入烧碱固体、浓硫酸、硝酸铵固体都能使a端液面高于b端液面
D. 若溶液比热容近似为4.18 J/(g℃),溶液密度近似为1g/mL。则该反应的中和热的数值为125.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x、y、z、w、n为五种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
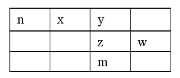
请回答下列问题:
(1)w位于周期表中第__________周期,第__________族。
(2)n、z、w、三种元素最高价氧化物水化物的酸性由弱到强的顺序为:__________(用化学式表示)。
(3)下列事实能说明y元素的非金属性比z元素的非金属性强的是____
A.y单质与z的气态氢化物水溶液反应,溶液变浑浊
B.在氧化还原反应中,1moly单质比1molz得电子多
C.y和z两元素的简单氢化物受热分解,前者的分解温度高
D.y元素最高价氧化物水化物酸性比z元素最高价氧化物水化物酸性强
(4)y和氢元素形成的10电子微粒中常见![]() 价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见
价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见![]() 价阴离子的电子式为__________。
价阴离子的电子式为__________。
(5)化合物nyz存在于天然气中,可以用NaOH溶液洗涤除去。化合物nyz的电子式为__________,其与NaOH溶液反应除生成两种正盐外,还有水生成,其化学方程式为__________。
(6)m元素的原子序数为__________,它是一种__________。(填“金属”或“非金属”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[c (H+)/c(OH-)]的关系如图所示(V=0时,

lg[c (H+)/c(OH-)]=-12)。下列说法正确的是( )
A. MOH的电离方程式为MOH![]() M++OH-
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数为(10/17)×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金、银、铝、镁、钛,均是人类大量生产和使用的金属。试回答下列问题:
(1)一个原子有多级电离能,从电子排布特点判断第三电离能大小:Mg______Al(填大于或等于或小于)。
(2)钛被称为继铁、铝之后的第三金属。第四周期元素中,未成对电子数目与基态钛原子未成对电子数目相同元素还有__________种。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中的位置_______。
(4)Ag+与氨水形成的二氨合银离子空间构型是直线形,其中配位原子的杂化类型是______。
(5)四氯化钛是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体,能与水蒸气反应发烟,生成二氧化钛固体,可以做烟幕剂。四氯化钛中存在的化学键类型是_______,写出上述反应的化学方程式____________________。
(6)工业用电解氯化镁制得镁,而不用氧化镁的原因___________________________。
(7)金单质的晶胞是面心立方结构,已知金相对原子质量为M,晶胞边长为d cm,则一个该晶胞占有的原子总质量为________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
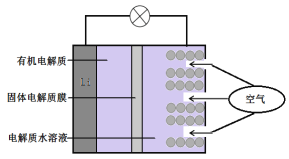
A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验. 实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验
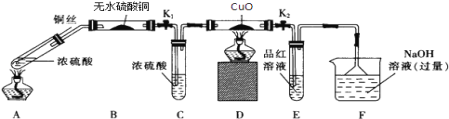
(1)A装置的试管中发生反应的化学方程式是________________________________;F装置的作用是______________________;B装置中的现象是_________________________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是:D装置中____________,E装置中_________________________。
(3)实验结束时,应先_________,再关闭K1 , K2,然后撤去所有酒精灯。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子,需将溶液稀释,操作方法是___________________________________________。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为a H2SO4+bCu ![]() cCu2S+dCuSO4+e H2O,则a:b=_________________。
cCu2S+dCuSO4+e H2O,则a:b=_________________。
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00mL 0.30molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为9.6g,则硫酸铜的产率为_____________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)(注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
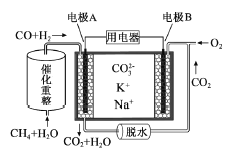
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com