
【题目】下列叙述中,能证明某物质是弱电解质的是( )
A.熔融时不导电
B.水溶液的导电能力很差
C.不是离子化合物,而是极性共价化合物
D.溶液中已电离的离子和未电离的分子共存
科目:高中化学 来源: 题型:
【题目】常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV的变化关系如图所示。下列叙述中错误的是
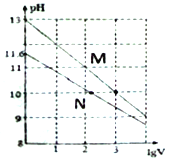
A. Ka1(CO32-)(Ka1为第一级水解平衡常数)的数量级为10-4
B. 曲线N表示Na2CO3溶液的pH随lgV的变化关系
C. Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[c (H+)/c(OH-)]的关系如图所示(V=0时,

lg[c (H+)/c(OH-)]=-12)。下列说法正确的是( )
A. MOH的电离方程式为MOH![]() M++OH-
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数为(10/17)×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
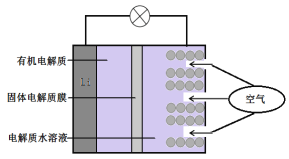
A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验. 实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验
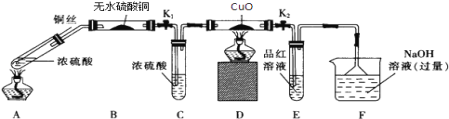
(1)A装置的试管中发生反应的化学方程式是________________________________;F装置的作用是______________________;B装置中的现象是_________________________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是:D装置中____________,E装置中_________________________。
(3)实验结束时,应先_________,再关闭K1 , K2,然后撤去所有酒精灯。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子,需将溶液稀释,操作方法是___________________________________________。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为a H2SO4+bCu ![]() cCu2S+dCuSO4+e H2O,则a:b=_________________。
cCu2S+dCuSO4+e H2O,则a:b=_________________。
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00mL 0.30molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为9.6g,则硫酸铜的产率为_____________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)(注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如图所示转化关系(反应条件略)。已知:①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
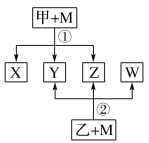
(1)Z是(写化学式):_____________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有______性。利用这种性质可以进行________项(填字母)实验操作。
A 钝化铁片 B 检验Ba2+ C 干燥氯气
(3)溴蒸气也是红棕色气体,可用来鉴别溴蒸气和X的是_________
A 湿润的淀粉碘化钾试纸 B 硝酸银溶液
C 湿润的pH试纸 D NaOH 溶液
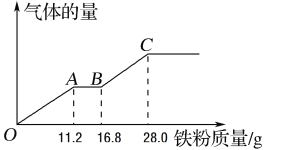
(4)现有甲和乙的稀溶液的混合溶液400 mL,将其平均分成两份。向其中一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示。OA段产生的气体是___________。如果向另外一份中逐渐加入铜粉,最多能溶解________g铜粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水处理的流程如下图。

(1)上述流程里,设备Ⅰ中进行的是操作______(填写操作名称)。实验室里这一步操作可以用__________进行(填写仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是__________,由设备Ⅲ进入设备Ⅳ的物质B是_________。
(3)在设备Ⅲ中发生反应的化学方程式为__________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2 O和__________。通过__________操作(填操作名称),可以使产物相互分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com