
【题目】已知有如图所示转化关系(反应条件略)。已知:①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
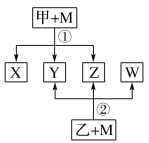
(1)Z是(写化学式):_____________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有______性。利用这种性质可以进行________项(填字母)实验操作。
A 钝化铁片 B 检验Ba2+ C 干燥氯气
(3)溴蒸气也是红棕色气体,可用来鉴别溴蒸气和X的是_________
A 湿润的淀粉碘化钾试纸 B 硝酸银溶液
C 湿润的pH试纸 D NaOH 溶液
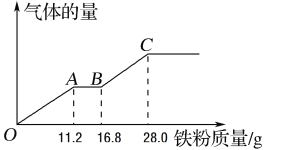
(4)现有甲和乙的稀溶液的混合溶液400 mL,将其平均分成两份。向其中一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示。OA段产生的气体是___________。如果向另外一份中逐渐加入铜粉,最多能溶解________g铜粉。
【答案】H2O 吸水 C B NO 19.2
【解析】
X是红棕色气体,即X为NO2,Y能使澄清石灰水变浑浊,但不能使品红溶液褪色,即Y是CO2,甲与M反应生成NO2和CO2,这是碳和浓硝酸的反应,即甲为浓硝酸,M为碳,浓硫酸具有吸收性,露置在空气中一段时间,吸收空气中水蒸气,质量增大,浓度降低,即乙为浓硫酸,然后进行分析;
X是红棕色气体,即X为NO2,Y能使澄清石灰水变浑浊,但不能使品红溶液褪色,即Y是CO2,甲与M反应生成NO2和CO2,这是碳和浓硝酸的反应,即甲为浓硝酸,M为碳,浓硫酸具有吸收性,露置在空气中一段时间,吸收空气中水蒸气,质量增大,浓度降低,即乙为浓硫酸,
(1)碳与浓硝酸反应C+4HNO3(浓)=CO2↑+4NO2↑+2H2O,碳和浓硫酸反应C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O,即Z为H2O;
(2)根据上述分析,利用浓硫酸的吸水性,A、钝化铁片,利用浓硫酸的氧化性,故A不符合题意;
B、利用SO42-检验Ba2+,故B不符合题意;
C、干燥氯气,利用浓硫酸的吸水性,故C符合题意;
(3)X为NO2,与水反应:3NO2+H2O=2HNO3+NO,
A、Br2和HNO3都具有强氧化性,将I-氧化成I2,试纸变蓝,故A不符合题意;
B、Br2蒸气溶于水,形成Br-,能与AgNO3溶液反应,生成AgBr淡黄色沉淀,NO2通入AgNO3溶液中无现象,故B符合题意;
C、溴蒸气溶于水形成HBr和HBrO,NO2溶于水形成HNO3,HBr和HNO3都是强酸,因此无法鉴别,故C不符合题意;
D、都能与NaOH溶液发生反应,产生的溶液均为无色,不能鉴别,故D不符合题意;
(4)铁粉都能与稀硝酸和稀硫酸反应,HNO3的氧化性强于稀硫酸,结合图中所给信息看,反应过程应是Fe+4H++NO3-=Fe3++NO↑+2H2O,Fe+2Fe3+=2Fe2+,Fe+2H+=Fe2++H2↑,NO3-全部被还原, OA段产生的气体是NO,根据离子方程式,求出n(HNO3)= n(Fe)= 11.2g/56g·mol-1=0.2mol,BC段得出溶液中最后的溶质为FeSO4,n(H2SO4)=n(Fe)=28.0g/56g·mol-1=0.5mol,铜与混酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,n(H+)=(0.2mol+0.5mol×2)=1.2mol,n(NO3-)=0.2mol,根据离子方程式,得H+过量,出NO3-不足,即最多消耗铜的物质的量为3×0.2mol/2=0.3mol,即最多消耗Cu的质量为0.3mol×64g·mol-1=19.2g。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.使用食品添加剂以后营养更丰富
B.天然食品添加剂比化学合成品安全可靠
C.食品添加剂的作用仅仅是为了好看
D.在食品包装的标签配料表上应注明食品添加剂的名称
查看答案和解析>>
科目:高中化学 来源: 题型:
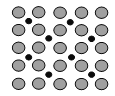
【题目】(1)诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,图为氮原子在铁的晶面上的单层附着局部示意图(图中小的黑色球代表氮原子,大的灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
(2)Cu与O形成的某种化合物X,其晶胞结构如下图所示。O在顶点和体心。已知X晶胞中原子坐标参数:A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。

物质结构用到多种模型,请结合模型完成下列问题:

(3)D图是CaTiO3晶胞模型,同一种微粒位置相同,Ca2+位于立方体的体心,则Ti4+位于____(填顶点或面心)
(4)已知A图是CsCl晶胞模型,体心为Cs+,与其紧邻等距离的Cs+数目有___________个。
(5)某分子中原子空间位置关系如B图所示,X位于立方体的顶点,Y位于立方体中心,用X,Y表示的化学式为______________。
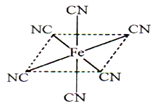
(6)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其阴离子结构如图。写出上述沉淀溶解过程的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,能证明某物质是弱电解质的是( )
A.熔融时不导电
B.水溶液的导电能力很差
C.不是离子化合物,而是极性共价化合物
D.溶液中已电离的离子和未电离的分子共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A与E同主族,E的单质是良好的半导体材料,D+核外电子排布与C2-相同。试回答(涉及到的物质均用化学式作答):
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是____________(写一个即可)。
(3)A、B和E最高价氧化物对应的水化物中,酸性最弱的是_________________(写化学式)。若用如图中装置验证这三种酸的酸性强弱,则在装置A中应加入______(写化学式),烧杯C观察到的实验现象是_____________________________。该实验装置存在不足,影响到实验目的的达成,改进方法是_____________。
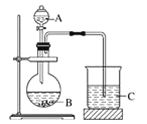
(4)B的最高价氧化物对应的水化物的稀溶液与B的气态氢化物反应的化学方程式为_____________
(5)用电子式表示D2C的形成过程:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A. 外电路的电流方向为X![]() 外电路
外电路![]() Y
Y
B. 若两电极分别为Fe和碳棒,则X 为碳棒,Y 为Fe
C. X 极上发生的是还原反应,Y 极上发生的是氧化反应
D. 若两电极都是金属,则它们的活泼性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程,属于吸热反应的是( )
①碳与水蒸气反应 ②将胆矾加热变为白色粉末 ③浓H2SO4稀释 ④氯化铵晶体溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌 ⑧碳酸钙热分解.
A. ①②④⑥⑦⑧ B. ①②⑥⑦ C. ④⑥⑦⑧ D. ①②⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )

A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:2H2O2 = 2H2O + O2 ΔH>0
D.反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A. ③⑤⑥ B. ①④⑤ C. 除②外都正确 D. ③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com