
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A与E同主族,E的单质是良好的半导体材料,D+核外电子排布与C2-相同。试回答(涉及到的物质均用化学式作答):
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是____________(写一个即可)。
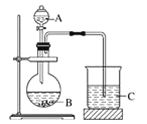
(3)A、B和E最高价氧化物对应的水化物中,酸性最弱的是_________________(写化学式)。若用如图中装置验证这三种酸的酸性强弱,则在装置A中应加入______(写化学式),烧杯C观察到的实验现象是_____________________________。该实验装置存在不足,影响到实验目的的达成,改进方法是_____________。
(4)B的最高价氧化物对应的水化物的稀溶液与B的气态氢化物反应的化学方程式为_____________
(5)用电子式表示D2C的形成过程:_______________________________________________
【答案】第3周期ⅣA族 H3O+或NH4+ H2SiO3或H4SiO4 HNO3 生成白色沉淀 在B和C之间增加一个装有饱和碳酸氢钠溶液的洗气瓶 HNO3 + NH3 === NH4NO3 ![]()
【解析】
E的单质是良好的半导体材料,即E为Si,A与E同主族,即A为C,五种元素原子序数依次增大,且都为短周期主族元素,根据D+和C2-核外电子排布相同,即D为Na,C为O,B为N,然后进行分析;
E的单质是良好的半导体材料,即E为Si,A与E同主族,即A为C,五种元素原子序数依次增大,且都为短周期主族元素,根据D+和C2-核外电子排布相同,即D为Na,C为O,B为N,
(1)Si位于周期表中第三周期IVA族;
(2)D+为Na+,质子数为11,电子数为10,具有相同电子数和质子数的微粒是H3O+、NH4+等;
(3)三种元素最高价氧化物对应的水化物分别是H2CO3、HNO3、H2SiO3,酸性强弱顺序是HNO3>H2CO3>H2SiO3,即酸性最弱的是H2SiO3或H4SiO4;根据三种酸的强弱顺序,A为硝酸,B为碳酸钠或碳酸氢钠,C为硅酸钠,烧瓶中发生2H++CO32-=CO2↑+H2O或H++HCO3-=H2O+CO2↑,C中发生反应:CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-,C中出现白色沉淀;因为HNO3挥发,B中产生CO2中混有HNO3,干扰CO2与Na2SiO3的反应,因此在B和C之间增加一个装有饱和碳酸氢钠溶液的洗气瓶;
(4)B的最高价氧化物对应水化物是HNO3,B的气态氢化物NH3,两者发生化学方程式为NH3+HNO3=NH4NO3;
(5)D2C为Na2O,属于离子化合物,其形成过程:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
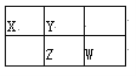
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的( )
A. 实验室用固体氯化铵和熟石灰共热制取NH3:2NH4++Ca(OH)2![]() 2NH3↑+ Ca2++2H2O
2NH3↑+ Ca2++2H2O
B. 铜与浓硝酸反应: 3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O
C. 氨水与FeCl3反应:3OH- + Fe3+ =Fe(OH)3↓
D. 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O===2HCO![]() +SO32-
+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从含有[Cu(NH3)4]SO4、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵[CuSO4·(NH4)2SO4]固体,完成了如下实验:
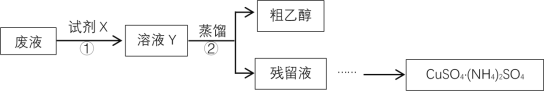
已知:[Cu(NH3)4]2++4H+==Cu2++4NH4+
请回答:
(1)步骤①中,试剂X应采用_____________________________________________。
(2)甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇含量明显偏低,可能的原因是_______________________________________________。
(3)设计实验方案验证硫酸铜铵固体中的NH4+___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如图所示转化关系(反应条件略)。已知:①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
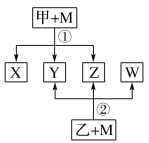
(1)Z是(写化学式):_____________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有______性。利用这种性质可以进行________项(填字母)实验操作。
A 钝化铁片 B 检验Ba2+ C 干燥氯气
(3)溴蒸气也是红棕色气体,可用来鉴别溴蒸气和X的是_________
A 湿润的淀粉碘化钾试纸 B 硝酸银溶液
C 湿润的pH试纸 D NaOH 溶液
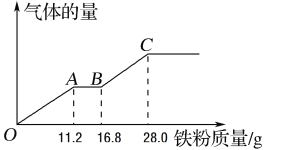
(4)现有甲和乙的稀溶液的混合溶液400 mL,将其平均分成两份。向其中一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示。OA段产生的气体是___________。如果向另外一份中逐渐加入铜粉,最多能溶解________g铜粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室做乙醛和银氨溶液发生银镜反应的实验时:
(1)为产生光亮的银镜,试管应先用______溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净。
(2)配制银氨溶液时向盛有__________溶液的试管中逐滴滴加__________溶液边滴边振荡直到__________为止。有关化学反应的离子方程式为:①_____________________;②_________________________。
(3)加热时应用________加热,产生银镜的化学方程式:____________________。
(4)实验室配制银氨溶液时若向AgNO 3 溶液中加入氨水形成银氨溶液时,应防止加入氨水过量,否则容易生成容易爆炸的________,试剂本身也失去灵敏性。配制好的银氨溶液不可久置,否则会生成________,从溶液中析出这种沉淀,哪怕是用玻璃棒刮擦也会分解发生猛烈的爆炸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)医院里检验糖尿病的方法是将病人尿液加入到CuSO4和NaOH的混合液中,加热后产生砖红色沉淀,说明病人的尿中含有_______;
(2)①用乙烯制备氯乙烷的化学方程式:________________,该反应的类型是__________。
②用苯制备硝基苯的化学方程式_______________,该反应的类型是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、________________。
(2)用碱式滴定管量取10.00mL待测液,置于锥形瓶中,同时滴加1-2滴指示剂。化学上常选用的指示剂有酚酞或____________。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视__________________,直到滴定到终点,若选择酚酞作为指示剂,判断滴定终点的标志是___________________________。
(4)根据下列数据,测得c(NaOH)=________。烧碱的纯度=____________。
滴定 次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.00 | 24.10 |
(5)以标准的盐酸溶液滴定未知浓度的氢氧化钠溶液,下列操作引起待测液浓度偏小的是 _______________(填序号)。
①读数:滴定前平视,滴定后俯视②未用待测液润洗碱式滴定管
③用待测液润洗锥形瓶④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com