
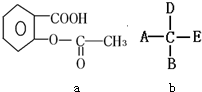
 I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3
I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3| 16 |
| 21.6% |
| 16 |
| 21.6% |
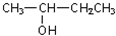 ,故答案为:
,故答案为: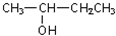 .
.


科目:高中化学 来源: 题型:
| A、原子半径:C>D>A>B |
| B、原子序数:C>D>B>A |
| C、离子半径:D>C>B>A |
| D、单质的还原性:B>A>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |

| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一样多 | B、Na最多 |
| C、Mg最多 | D、Al最多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com