
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是

科目:高中化学 来源: 题型:
| A、CaCl2=Ca2++2Cl- |
| B、H2CO3?H++HCO3- |
| C、NaHCO3=Na++H++CO32- |
| D、NaClO=Na++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH?H++CH3COO- |
| B、KHSO4?H++SO42-+K+ |
| C、H2CO3?2H++CO3 2- |
| D、NaH2PO4?Na++H2PO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
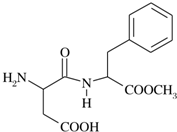 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
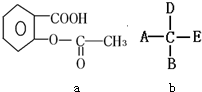 I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3
I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3查看答案和解析>>
科目:高中化学 来源: 题型:
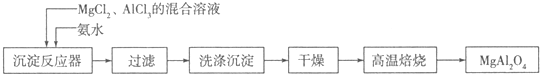
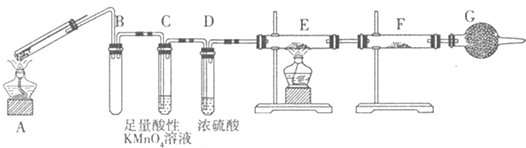
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com