
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |


科目:高中化学 来源: 题型:
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是查看答案和解析>>
科目:高中化学 来源: 题型:
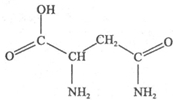 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
| 编号 | I5/kJ?mol-1 | I6/kJ?mol-1 | I7/kJ?mol-1 | I8/kJ?mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一样多 | B、Na最多 |
| C、Mg最多 | D、Al最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、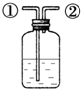 用排饱和食盐水法收集氯气,瓶内装饱和食盐水,氯气从①口进,②口出 |
B、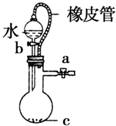 该装置中橡皮管的作用是能使水顺利流下 |
C、 除去苯中的己烷 |
D、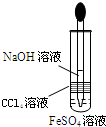 制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 配制100mL 0.1mol?L-1的硫酸 |
B、 吸收氨气并防止倒吸 |
C、 制取少量乙烯气体 |
D、 验证溴乙烷发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol Na2O2与足量水完全反应时,转移电子数目为0.1NA |
| B、12g金刚石含有的共价键数为2NA |
| C、0.1mol的铜与足量的浓硫酸反应生成SO2的体积(标况)约为2.24L |
| D、标况下,22.4L CH3Cl和CH2Cl2的混合物所含氯原子数介于NA至2NA之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清透明的溶液中:H+、Fe2+、SO42-、NO3- |
| B、使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- |
| C、0.1 mol?L-1的BaCl2溶液中:K+、Na+、OH-、NO3- |
| D、由水电离出的c(H+)=10-12 mol?L-1的溶液中:Mg2+、K+、Br-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com