
| n |
| V |
| 5mol/L×aml×2 |
| bml |
| 10a |
| b |
| 10a |
| b |
| 14.6g |
| 36.5g/mol |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
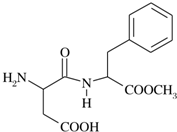 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求完成下列问题:
按要求完成下列问题: ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子方程式 | 结论 |
| A | AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | 溶解度:AgI>AgCl |
| B | Fe2++H2O2+2H+═Fe3++2H2O | 氧化性:H2O2>Fe3+ |
| C | CO32-+CO2+H2O═2HCO3- | 稳定性:HCO3->CO32- |
| D | NH3+H3O+═NH4++H2O | 得质子能力:NH3>H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| C、1 L 1mol?L-1的CH3COONa溶液中含有CH3COO-的数目为NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.1NA个乙炔分子完全燃烧需要的O2的体积约为11.2L |
| B、标准状况下,11.2L乙烯分子中含有的碳碳共用电子对数目为0.5NA |
| C、15g乙烷分子中含有的碳氢键数目为3NA |
| D、常温常压下,1 mol氦气含有的核外电子数为4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com