
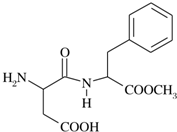
 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.

 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
| A、a>b>c |
| B、a>c>b |
| C、c>b>a |
| D、b>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、②③⑤⑥ |
| C、①②④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaAlO2(aq) |
| CO2 |
| O2 |
| H2O |
| HCl(aq) |
| △ |
| NH3CO2 |
| △ |
| △ |
| 通电 |
| 熔化 |
| NaOH(aq) |
| 葡萄糖 |
| △ |
| A、②④⑥ | B、③④⑤ |
| C、②⑤⑥ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率[×10-3 mol?(L?min)-1] | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com