
| A、CH3COOH?H++CH3COO- |
| B、KHSO4?H++SO42-+K+ |
| C、H2CO3?2H++CO3 2- |
| D、NaH2PO4?Na++H2PO4- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
| B、常温常压下,32gO2和32gO3所含氧原子数都是2NA |
| C、1molFe与足量盐酸反应,Fe所失去的电子数为3NA |
| D、l00mLlmol/LNaCl溶液与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,铅蓄电池是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
如图所示,铅蓄电池是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-| 放电 |
| 充电 |
| A、放电时,正极反应是Pb-2e-+SO42-=PbSO4 |
| B、放电时,外电路中电子流动方向由B到A |
| C、放电时,铅蓄电池的负极质量增加,正极质量减小 |
| D、充电时,该装置中化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、②③⑤⑥ |
| C、①②④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaAlO2(aq) |
| CO2 |
| O2 |
| H2O |
| HCl(aq) |
| △ |
| NH3CO2 |
| △ |
| △ |
| 通电 |
| 熔化 |
| NaOH(aq) |
| 葡萄糖 |
| △ |
| A、②④⑥ | B、③④⑤ |
| C、②⑤⑥ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是查看答案和解析>>
科目:高中化学 来源: 题型:
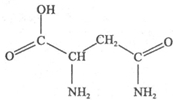 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
| 编号 | I5/kJ?mol-1 | I6/kJ?mol-1 | I7/kJ?mol-1 | I8/kJ?mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com