
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法;B加热分解;C结晶法;D分液法;E蒸馏法;F过滤法
(1)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(2)分离水和汽油的混合物;
(3)分离饱和食盐水与泥沙的混合物;
(4)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物;
科目:高中化学 来源: 题型:填空题
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下: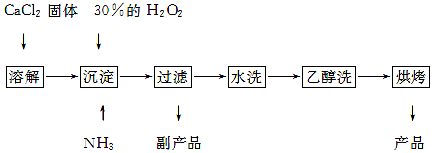
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
① ;
② 。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是________,发生反应的离子方程式为________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是______________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为_______________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为______________________________。
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C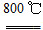 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C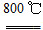 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C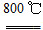 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。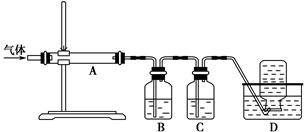
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
(1)焙烧时,焦炭需过量,其目的是:①____________________________;②____________________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO4(s) BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
反应器中发生反应的化学方程式为____________________________________。
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,需先后加入H2O2溶液和碳酸锌精制,加入H2O2溶液时发生反应的离子方程式为
________________________________,加入碳酸锌的目的是将溶液中的Fe3+转化为红褐色沉淀,写出该反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电源,实验室尝试利用废旧钴酸锂锂离子电池回收铝、铁、铜、钴、锂元素,实验过程如下:
(1)碱浸泡过程中,铝被溶解的离子方程式为__________________________
(2)滤液A中加入草酸铵溶液,使Co元素以CoC2O4·2H2O沉淀形式析出。草酸钴是制备氧化钴及钴粉的重要原料。在空气中CoC2O4·2H2O的热分解失重数据见下表,请补充完整表中的热分解方程式。
| 序号 | 温度范围/℃ | 热分解方程式 | 固体失重率 |
| ① | 120~220 | | 19.67% |
| ② | 280~310 | | 56.10% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
选择下列实验方法分离物质,将最好的分离方法的序号填在横线上。
| A.萃取分液法 | B.加热法 | C.结晶法 | D.分液法 E.过滤法 F.蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应l”反应速率的措施有________________________(写出一条即可)。
(2)“反应2”的氧化剂是_____________,该反应的化学方程式为__________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从“母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钡盐行业生产中排出大量的钡泥[主要含有 、
、 、
、 、
、 等]。某主要生产
等]。某主要生产 、
、 、
、 的化工厂利用钡泥制取
的化工厂利用钡泥制取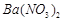 ,其部分工艺流程如下:
,其部分工艺流程如下:
(1)酸溶后溶液中 ,
, 与
与 的反应化学方程式为 。
的反应化学方程式为 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,
原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com