
【题目】工业上可以用废铁屑制备活性Fe3O4,流程如下图:

(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):
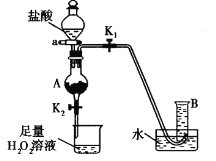
操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
① 操作Ⅱ中“……”的内容是______________,烧杯中的现象是_________________,并有气泡产生。相应的方程式是________________、________________。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是![]() ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
【答案】增大反应物之间的接触面积,增加反应速率,提高生产效率 Fe2++2Fe3++8OH-=Fe3O4+4H2O 4:1 当A中固体完全消失 无色溶液逐渐变黄 2Fe2++H2O2+2H+=2Fe3++2H2O 2H2O2![]() 2H2O+O2↑ Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
2H2O+O2↑ Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
【解析】
根据物质的制备、分离和提纯的操作及注意事项分析解答;根据氧化还原反应的本质和特征分析解答;根据铁及其化合物的性质分析解答。
(1) 固体的表面积越大,反应速率越快,所以在工业生产中,将块状固体磨成粉末,并在反应池中安装搅拌机,目的是增加反应速率,故答案为:增大反应物之间的接触面积,增加反应速率,提高生产效率;
(2) Fe2+与Fe3+在碱性条件下反应生成Fe3O4,反应的离子方程式为:Fe2++2Fe3++8OH-=Fe3O4↓+4H2O;故答案为:Fe2++2Fe3++8OH-=Fe3O4↓+4H2O;
(3) 没有气体产生,说明铁刚好使三价铁转化为二价铁,由于在1molFe3O4中可以认为有1molFeO和1molFe2O3,设Fe为xmol,Fe2O3为ymol,生成1molFe3O4,根据Fe+2Fe3+=3Fe2+则有:x+2y=3;3x=1,解得x=![]() mol;y=
mol;y=![]() mol,故Fe2O3与Fe物质的量之比为4:1;故答案为:4:1;
mol,故Fe2O3与Fe物质的量之比为4:1;故答案为:4:1;
(4) ①当A中固体完全消失,铁完全和盐酸反应后,反应结束;当A中溶液完全进入烧杯,生成的FeCl2被氧化成黄色的FeCl3,生成的FeCl3作催化剂,使H2O分解,反应的方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2![]() 2H2O+O2↑,故答案是:当A中固体完全消失;无色溶液逐渐变黄,有气泡产生;2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2
2H2O+O2↑,故答案是:当A中固体完全消失;无色溶液逐渐变黄,有气泡产生;2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
②由于废铁屑中含有Fe2O3,和盐酸反应生成的Fe3+能够和Fe反应,导致Fe减少,置换的氢气体积减少,故答案是:Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少。


科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,请参照N元素的位置,回答下列问题:
① | N | |||||||
② | ③ | ④ | ⑤ |
请回答下列问题:
(1)写出第4周期、与⑤同族元素的名称:___________。
(2)①的单质被称为“21世纪的能源金属”,可用于制造电池和储存氢气,其氢化物可以与水反应生成氢气。其氢化物电子式为___________;写出该氢化物与水反应的化学方程式_____________________。
(3)镓(Ga)与②同主族,写出镓的氧化物与NaOH反应的化学方程式为____________。
(4)③元素的非金属性比④______(填“强”或“弱”),列举一个化学事实加以说明_______________________________________________。
(5)N元素存在N2和N4等同素异形体。已知N4为正四面体结构,N—N键能为167 kJ·mol-1;N≡N键能为942 kJ·mol-1。写出N4(g)转化为N2(g)的热化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法错误的是( )

A. 原子半径:W>Y>Z>M>X
B. 酸性:HYO3>H2WO3
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硫酸铜溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应是H2+2NiO(OH)![]() 2Ni(OH)2,则下列说法正确的是( )
2Ni(OH)2,则下列说法正确的是( )
A. 电池放电时,H2在正极发生氧化反应
B. 电池工作时,电子从负极经导线流向正极,再由正极经电解质溶液流向负极
C. 正极的电极方程式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
D. 该电池充电放电为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol/L H2SO4的含义是
A.1L 水中含有1mol H2SO4 B.1L 溶液中含有1mol H+
C.1L H2SO4溶液中含98g H2SO4 D.将98g H2SO4溶于1L水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在元素周期表中的位置如图,其中Z的原子半径最小。下列说法正确的是( )

A. M元素一定为金属元素
B. X元素的最简单气态氢化物的热稳定性比Z的强
C. 若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱
D. Z元素与氢元素能形成原子个数比为1∶1的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1molL-1NaOH溶液滴定20mL 0.1molL-1 H2SO3溶液的滴定曲线如图所示.下列说法正确的是

A. a点:c(H2SO3)+ c(HSO3-)+c(SO32-)=0.1molL-1
B. b点:c(Na+)>c(HSO3-.)> c(H2SO3)> c(SO32-)
C. 溶液导电性b>c
D. a、b、c、d中,d点水的电离度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com