
【题目】镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应是H2+2NiO(OH)![]() 2Ni(OH)2,则下列说法正确的是( )
2Ni(OH)2,则下列说法正确的是( )
A. 电池放电时,H2在正极发生氧化反应
B. 电池工作时,电子从负极经导线流向正极,再由正极经电解质溶液流向负极
C. 正极的电极方程式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
D. 该电池充电放电为可逆反应
科目:高中化学 来源: 题型:
【题目】甲烷可制成燃料电池,其装置如图所示。下列说法正确的是

A. a极是正极
B. b极电极反应式为:O2-4e- +4H+=2H2O
C. 电解质溶液可能为碱性溶液
D. 甲烷燃料电池具有无污染、高效率的优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。沉淀E与稀硫酸反应的离子方程式为__________________________________________。溶液G与过量稀氨水反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法适合实验室制取氨气的是
A.N2和H2催化加热制取氨气
B.加热NH4HCO3制取氨气
C.将浓氨水向生石灰固体上滴加
D.将NH4Cl稀溶液和NaOH稀溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用废铁屑制备活性Fe3O4,流程如下图:

(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):
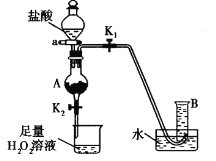
操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
① 操作Ⅱ中“……”的内容是______________,烧杯中的现象是_________________,并有气泡产生。相应的方程式是________________、________________。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是![]() ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8 molD。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8 molD。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH ______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“变”)。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各![]() mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。

A. 温度:T1>T2>T3
B. 正反应速率:v(b)>v(d) v(a)>v(c)
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
i.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1
H2S(g)+CO2(g) △H1
ii.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知反应中相关的化学键键能数据如下表:

①恒温恒压下,密闭容器中发生反应i。下列事实能说明反应i达到平衡状态的是_______。(填标号)
a.容器的体积不再改变 b.化学平衡常数不再改变 c.混合气体的密度不再改变 d.形成1molH—O键,同时形成1molH—S键

②一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(α)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)

③反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中 表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10L的恒容密闭容器中充入2molCOS(g)和1molH2(g),发生反应ii,CO的平衡转化率为___________。
(2)过二硫酸是一种强氧化性酸,其结构式为
①Ag+催化下,S2O82-与Mn2+在水溶液中生成SO42-和MnO4-,该反应离子方程式____________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为____________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq)HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com