
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
i.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1
H2S(g)+CO2(g) △H1
ii.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知反应中相关的化学键键能数据如下表:

①恒温恒压下,密闭容器中发生反应i。下列事实能说明反应i达到平衡状态的是_______。(填标号)
a.容器的体积不再改变 b.化学平衡常数不再改变 c.混合气体的密度不再改变 d.形成1molH—O键,同时形成1molH—S键

②一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(α)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)

③反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中 表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10L的恒容密闭容器中充入2molCOS(g)和1molH2(g),发生反应ii,CO的平衡转化率为___________。
(2)过二硫酸是一种强氧化性酸,其结构式为
①Ag+催化下,S2O82-与Mn2+在水溶液中生成SO42-和MnO4-,该反应离子方程式____________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为____________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq)HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_____________________。
【答案】d ABC B 33.3% 5S2O82-+2Mn2++8H2O==10SO42-+2MnO4-+16H+ 2SO42-+2H+==S2O82-+H2 ![]() 4X10-53
4X10-53
【解析】
(1) ①由反应 i.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1知反应前后化学反应计量数相等,所以a.容器的体积不再改变不能说明达到平衡状态;b.化学平衡常数只与温度有关,与浓度无关,所以b.化学平衡常数不再改变不能判断是否达到化学平衡状态; 因为混合气体的容积不变,所以c.混合气体的密度不再改变不能判断是否达到化学平衡状态;d.因为H2O(g)、H2S(g)在等号的两侧,且系数相等,所以形成1molH—O键,同时形成1molH—S键能证明达到化学平衡状态;故D正确;
H2S(g)+CO2(g) △H1知反应前后化学反应计量数相等,所以a.容器的体积不再改变不能说明达到平衡状态;b.化学平衡常数只与温度有关,与浓度无关,所以b.化学平衡常数不再改变不能判断是否达到化学平衡状态; 因为混合气体的容积不变,所以c.混合气体的密度不再改变不能判断是否达到化学平衡状态;d.因为H2O(g)、H2S(g)在等号的两侧,且系数相等,所以形成1molH—O键,同时形成1molH—S键能证明达到化学平衡状态;故D正确;
②跟据化学反应平均速率公式,COS和H2S的化学计量数相同,二者化学反应速率相等,在整个反应中,始终有v(COS)=v(H2S),故ABC三点全部符合;
③反应ii的焓变为:745+580+436-339*2-1076kJ/mol=7 kJ/mol,正反应为吸热反应,温度升高有利于正反应进行,所以(K逆)为B;
T1温度时,正逆反应化学平衡常数相等均为1,设反应达到平衡时转化COS为xmol/L,则![]() 容器中各物质的物质的量浓度为:c(COS)=(0.2-x)mol/L,c(H2)=(0.1-x)mol/L,c(H2S)=xmol/L,c(CO)=xmol/L, 由K正= c(H2S)
容器中各物质的物质的量浓度为:c(COS)=(0.2-x)mol/L,c(H2)=(0.1-x)mol/L,c(H2S)=xmol/L,c(CO)=xmol/L, 由K正= c(H2S)![]() / c(COS)
/ c(COS)![]() c(H2)=x2/(0.2-x)
c(H2)=x2/(0.2-x)![]() (0.1-x)=1,可得x=1/15,则COS的平均转化率为:
(0.1-x)=1,可得x=1/15,则COS的平均转化率为:![]() 0.2)
0.2)![]() =33.3
=33.3![]()
(2).①Ag+作为催化剂,S2O82-、Mn2+与水为反应物,SO42-和MnO4-为生成物,同时生成H+,离子方程式为:5S2O82-+2Mn2++8H2O==10SO42-+2MnO4-+16H+;
②由题意得出反应方程式为:H2SO4+(NH4)2SO4![]() (NH4)2S2O8+H2↑,写成离子反应方程式为:2H++2SO42—
(NH4)2S2O8+H2↑,写成离子反应方程式为:2H++2SO42—![]() S2O82-+H2↑;
S2O82-+H2↑;
(3)①S原子核外电子最外层有6个电子,其与H原子共用一对电子,从Na原子获得一个电子,从而形成稳定结构,电子式为![]() ;反应的平衡常数k=c(H+)/c(HS-)
;反应的平衡常数k=c(H+)/c(HS-)![]() c(Hg2+)= c(H+)
c(Hg2+)= c(H+)![]() c(S2-)/c(HS-)
c(S2-)/c(HS-)![]() c(Hg2+)
c(Hg2+)![]() c(S2-)=1.7510-39,则Kp=Ka2/K=7.0
c(S2-)=1.7510-39,则Kp=Ka2/K=7.0![]() 10-15/1.7510-39=4X10-53
10-15/1.7510-39=4X10-53


科目:高中化学 来源: 题型:
【题目】镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应是H2+2NiO(OH)![]() 2Ni(OH)2,则下列说法正确的是( )
2Ni(OH)2,则下列说法正确的是( )
A. 电池放电时,H2在正极发生氧化反应
B. 电池工作时,电子从负极经导线流向正极,再由正极经电解质溶液流向负极
C. 正极的电极方程式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
D. 该电池充电放电为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。该电池工作时,有关说法正确的是( )

A. 铝罐将逐渐被腐蚀
B. 炭粒和炭棒上发生的反应为O2+4e- = 2O2-
C. 炭棒应与玩具电机的负极相连
D. 该电池工作一段时间后炭棒和炭粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是 ( )

A. 如图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1molL-1NaOH溶液滴定20mL 0.1molL-1 H2SO3溶液的滴定曲线如图所示.下列说法正确的是

A. a点:c(H2SO3)+ c(HSO3-)+c(SO32-)=0.1molL-1
B. b点:c(Na+)>c(HSO3-.)> c(H2SO3)> c(SO32-)
C. 溶液导电性b>c
D. a、b、c、d中,d点水的电离度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位),分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由___________决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明________对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,_________反应速率越快。
(2)我们最好选取实验_________(填实验序号)研究锌的形状对反应速率的影响。我们发现在其它条件相同时,反应物间的_______反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是_____________________________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体内某些有机物的元素组成可表示如下,据图回答:

(1)A的功能多样性是由A的__________多样性决定的,其中A3指的是__________,可以用__________试剂检测A物质,产生的颜色变化是__________。
(2)小分子a的名称为__________,结构通式为__________。
(3)B如果是主要的能源物质,则b是__________,在动物细胞中B有两种,分别是__________和__________。如果B是植物细胞壁的成分,则B是__________。
(4)小分子c的名称为__________,C1的中文名称为__________。
(5)与B物质有相同的元素组成,被称为细胞内良好储能物质的是__________,可用__________试剂检测,产生的颜色变化是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂不仅是营养物质和主要食物,也是一种重要的工业原料。下面是以油脂为主要原料获得部分产品的合成路线:

己知:①G (C10H10O4)分子中的官能团处于对位;
②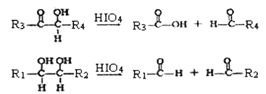
(R1、R2、R3与R4可能是氢、烃基或其他基团)
回答下列问题:
(1)下列关于油脂的说法正确的是____。(填标号)
a.油脂包括植物油和脂肪,属于酯类
b.天然油脂是混合甘油酯组成的混合物,无固定的熔点和沸点
c.油脂属天然高分子化合物,许多油脂兼有烯烃的化学性质
d.硬化油又叫人造脂肪,便于储存和运输,但容易被空气氧化变质
(2)G中官能团的名称为______,反应①的反应类型为_________。
(3)用系统命名法写出F的名称___________。
(4)在酸催化下物质的量的B与苯酚反应生成一种线型结构高分子的化学方程式为______________________。
(5)二元取代芳香化合物H是G的同分异构体,H满足下列条件:
①能发生银镜反应
②酸性条件下水解产物物质的量之比为2:1
③不与NaHCO3溶液反应。
则符合上述条件的H共有______种(不考虑立体结构,不包含G本身)。其中核磁共振氢谱为五组峰的结构简式为________(写出一种即可)。
(6)写出从HOCH2CH2OH![]() HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种关于酸的使用,其中正确的是
A. 为了抑制Fe2+的水解,用稀硝酸酸化 B. 检验溶液中是否含有SO![]() 时,先用盐酸酸化
时,先用盐酸酸化
C. 乙酸与乙醇的酯化反应中,浓硫酸起到了催化剂和脱水剂的作用 D. 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com