
对水的电离平衡不产生影响的粒子是( )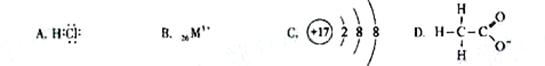
科目:高中化学 来源: 题型:单选题
25℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得
c(Na+)>c(A-),则下列描述中,不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mo1+n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
| A.x=10-2y | B.x >y | C.x=y | D.x=102y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
| | AgCl | AgI | Ag2S |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数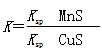 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )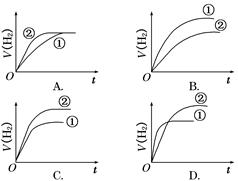
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A.NaHB属于弱电解质 |
| B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-] |
| C.[Na+]=[HB-]+[B2-]+[H2B] |
| D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com