
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数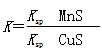 |
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:单选题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-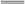 Al(OH)3↓ Al(OH)3↓ |
| B.其溶液的pH=13 |
| C.用适量水稀释后,NH3·H2O电离度和溶液pH都增大 |
| D.加水稀释后,溶液中c(NH4 +)·c(OH-)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某浓度的氨水中存在下列平衡:NH3·H2O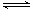 NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A.适当升高温度 | B.加入水 | C.通入NH3 | D.加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是
H++OH-,下列叙述中正确的是
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有室温下的四种溶液,有关叙述不正确的是
| 编号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃时,5种银盐的溶度积常数(Ksp)分别是:
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(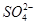 )
)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
| A.只有AgBr沉淀生成 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主 |
| D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com