
【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D
【答案】C
【解析】
A. 未指出Na2CO3和NaHCO3溶液的浓度,所以不能根据溶液的pH大小,判断盐水解程度的大小,A错误;
B.先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,发生沉淀反应,产生白色AgCl沉淀,由于AgNO3溶液过量,所以再向其中滴加0.1mol/L的NaI溶液,会发生沉淀反应,产生AgI黄色沉淀,所以不能证明AgCl沉淀可转化成AgI沉淀,B错误;
C.电解饱和CuCl2溶液,在阴极产生Cu单质,阳极产生Cl2,由于Cl2具有氧化性,在溶液中与KI发生置换反应产生I2,I2遇淀粉溶液变为蓝色,因此润湿的淀粉—碘化钾试纸靠近阳极,试纸变为蓝色,C正确;
D.饱和FeCl3溶液中存在盐的水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,加入固体NaCl,该盐电离产生的Na+、Cl-与盐的水解平衡无关,因此对盐的水解平衡无影响,因此溶液的颜色不会发生变化,D错误;
Fe(OH)3+3H+,加入固体NaCl,该盐电离产生的Na+、Cl-与盐的水解平衡无关,因此对盐的水解平衡无影响,因此溶液的颜色不会发生变化,D错误;
故答案是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Y、Z三种元素可组成酸,且受热易分解
D.由X、Z、W三种元素可组成碱,且受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
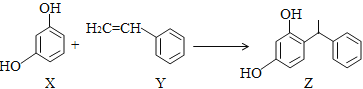
下列叙述正确的是( )。
A. X、Y和Z均能使溴水褪色,且原理相同
B. X和Z均能与Na2CO3溶液反应放出CO2
C. X、Y和Z分子中的所有原子可能共平面
D. X苯环上一氯代物有3种,Y苯环上的二氯代物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A. 相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布图为_____。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是____________。
(3)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,同时得到一种最简单的有机物,写出该反应的方程式为_____;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm(1pm=10-12m),则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
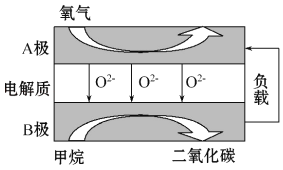
(1)B极电极反应式为______________________。
(2)若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,写出阳极的电极反应式________;当阳极收集到11.2L(标准状况)气体时,消耗甲烷的质量为__________g;电解硫酸铜溶液一段时间后,阴极无气体产生,要使原溶液复原,可向电解后的溶液中加入___________________。
(3)目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
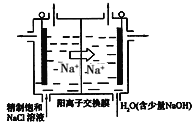
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_____(填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式___________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() 。下列相关说法不正确的是 ( )。
。下列相关说法不正确的是 ( )。
A.苹果酸能发生酯化反应的官能团有3个
B.苹果酸在一定条件下能发生催化氧化反应
C.1 mol苹果酸与足量Na反应生成33.6 L H2
D.1 mol苹果酸与NaHCO3溶液反应,最多消耗2 mol NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:________________________。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式为__________________。
④当看到装置C中导管液面上升时应进行的操作是______________________。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______________________作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2S2O32- = 2I- +S4O62-),当看到____________________________现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com