
【题目】以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
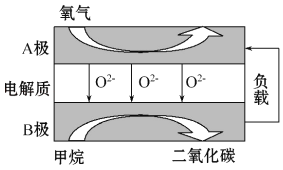
(1)B极电极反应式为______________________。
(2)若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,写出阳极的电极反应式________;当阳极收集到11.2L(标准状况)气体时,消耗甲烷的质量为__________g;电解硫酸铜溶液一段时间后,阴极无气体产生,要使原溶液复原,可向电解后的溶液中加入___________________。
(3)目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
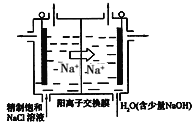
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_____(填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式___________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的数目为__________。
【答案】CH4-8e-+4O2-=CO2+2H2O 2H2O-4e-=O2↑+4H+ 4 CuO 右 Cl--5e-+2H2O=ClO2+4H+ 0.01NA
【解析】
(1)B电极CH4变为CO2,根据阴离子移动方向,结合原电池反应原理,判断电极的正负,并写出电极反应式;
(2)用惰性电极电解硫酸铜溶液,阳极上溶液中OH-放电;阴极上溶液中的Cu2+放电;若阴极无气体放出,说明阴极只发生了反应:Cu2++2e-=Cu;两个电极析出的物质反应后得到的物质就是使溶液复原需加入的物质;
(3)①根据离子移动方向确定电解池的阳极、阴极,电解池的阴极接电源的负极;阳极上Cl-失去电子变为ClO2;
②阴极上溶液中的H+获得电子变为氢气,根据电子转移守恒,计算通过阳离子交换膜的阳离子的数目。
(1)由阴离子移动方向可知B电极为负极,在负极上甲烷失电子发生氧化反应,电极反应式为:CH4-8e-+4O2-=CO2+2H2O;
(2)用石墨电极电解硫酸铜溶液,石墨电极为惰性电极,电解硫酸铜溶液,实质上是溶液中的离子放电。在阳极上溶液中OH-放电,所以阳极的电极反应式为:2H2O-4e-=O2↑+4H+;阴极上溶液中的Cu2+放电,电极反应式为Cu2++2e-=Cu;阳极产生的是O2,每产生1molO2,转移4mol电子,n(O2)=11.2L÷22.4L/mol=0.5mol,则n(e-)=0.5×4=2mol,由于同一闭合回路中电子转移数目相等,所以根据CH4-8e-+4O2-=CO2+2H2O可知消耗1mol甲烷,转移8mol电子,则转移2mol电子,会消耗CH4的物质的量为n(CH4)=2mol÷8=0.25mol,则消耗甲烷的质量为m(CH4)=0.25mol×16g/mol=4g;
电解硫酸铜溶液一段时间后,若阴极无气体产生,则电解反应方程式为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,要使原溶液复原,可向电解后的溶液中加入的物质是Cu与O2反应产生的CuO;
2Cu+O2↑+2H2SO4,要使原溶液复原,可向电解后的溶液中加入的物质是Cu与O2反应产生的CuO;
(3)①Na+向阴极移动,阴极连接原电池的负极,接燃料电池中通入甲烷的电极;所以甲烷燃料电池的负极应该接该装置的右边的电极;在阳极上,溶液中的Cl-失去电子,变为ClO2,电极反应式为:Cl--5e-+2H2O=ClO2+4H+;
②阴极电极反应为2H2O+2e-=H2↑+2OH-,氢气的物质的量为n(H2)=0.112L÷22.4L/mol=0.005mol,阴极区产生0.01molOH-,通过阳离子交换膜的是+1价阳离子,故通过阳离子交换膜的阳离子的物质的量为0.01mol,通过的阳离子的数目为0.01NA。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 对2NO2(g)![]() N2O4(g) △H<0, 升高温度平衡体系颜色变深
N2O4(g) △H<0, 升高温度平衡体系颜色变深
D. SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到1.12 L标准状况下的气体(假设只有NO2、NO),则反应消耗的硝酸的物质的量可能是
A.0.11 molB.0.1 molC.0.09 molD.0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式。
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量,热化学方程式______________________________
(2)命名有机物: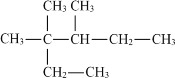 ______________________________
______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. lmol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B. 27g铝中加入1L 1 mol/L的NaOH溶液,转移电子数是3NA
C. 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,是无色透明、具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。
实验一:制备NaClO溶液。(实验装置如图1所示)

(1)下列仪器在配制100 mL7.5mol/L的NaOH溶液时,可能用到的有_______(填字母)。
A.容量瓶 B.烧瓶 C.胶头滴管 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式为____。
实验二:制取水合肼。(实验装置如图2所示)
(3)①装置A的名称为____,反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:____________,故分液漏斗中的溶液是_____(填字母)。
A. CO(NH2)2溶液 B. NaOH和NaClO
②充分反应后,加热A内的溶液,收集108~114℃的馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0 g,加入适量NaHCO3固体,加水配成250 mL溶液,移岀25.00 mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10 mol/L的标准I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2=N2↑+ H2O+4HI)
滴定时,碘的标准溶液盛放在____(填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为____。实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是广泛用于橡胶工业的硫化剂,常温下
是广泛用于橡胶工业的硫化剂,常温下![]() 是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与
是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与![]() 类似
类似![]() 下列说法错误的是
下列说法错误的是![]()
A. ![]() 分子中的两个S原子均是
分子中的两个S原子均是![]() 杂化
杂化
B. ![]() 与
与![]() 反应的化学方程式可能为:
反应的化学方程式可能为:![]()
C. ![]() 与
与![]() 结构相似,熔沸点
结构相似,熔沸点![]()
D. ![]() 分子中的S为
分子中的S为![]() 价,是含有极性键和非极性键的非极性分子
价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CsF是离子晶体,其晶格能可通过下图的循环计算得到,以下说法错误的是
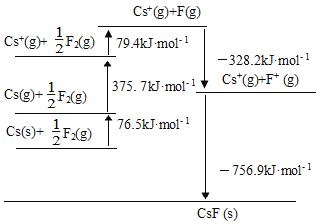
A. Cs原子的第一电离能为452.2 kJ·mol1
B. F-F键的键能为158.8 kJ·mol1
C. CsF的晶格能756.9kJ·mol1
D. 1molCs(s)转变成Cs(g)所要吸收的能量为76.5kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com