


| 浓H2SO4,浓HNO3 |
| △ |
| Br2,Fe |
| 反应Ⅰ |
| 试剂X |
| 反应Ⅱ |
| NaOH溶液 |
| △ |
| Fe,HCl,H2O |
| 反应Ⅲ |
| 试剂Y |

 :
: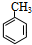 与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成A,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成A,则A为
与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成A,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成A,则A为 ,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为
,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为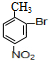 ,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,
,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应, 被酸性高锰酸钾氧化生成C,则C为
被酸性高锰酸钾氧化生成C,则C为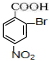 ,C在碱性条件下水解生成D为
,C在碱性条件下水解生成D为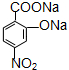 ,D在Fe、HCl、水条件下发生还原生成E,则E为
,D在Fe、HCl、水条件下发生还原生成E,则E为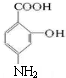 ,E与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题.
,E与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题. 与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成A,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成A,则A为
与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成A,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成A,则A为 ,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为
,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为 ,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,
,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应, 被酸性高锰酸钾氧化生成C,则C为
被酸性高锰酸钾氧化生成C,则C为 ,C在碱性条件下水解生成D为
,C在碱性条件下水解生成D为 ,D在Fe、HCl、水条件下发生还原生成E,则E为
,D在Fe、HCl、水条件下发生还原生成E,则E为 ,E与碳酸氢钠反应生成氨基水杨酸钠,
,E与碳酸氢钠反应生成氨基水杨酸钠, 的反应方程式为
的反应方程式为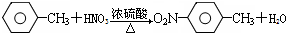 ,故答案为:
,故答案为: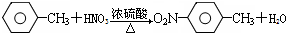 ;
; ,故答案为:
,故答案为: ;
; 发生取代反应生成
发生取代反应生成 ,反应II是
,反应II是 被酸性高锰酸钾氧化生成
被酸性高锰酸钾氧化生成 ,反应Ⅲ是
,反应Ⅲ是 被还原成
被还原成 ,
,

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

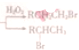 (R:烃基或氧原子,R′:烃基)
(R:烃基或氧原子,R′:烃基)
| OH- |
| -H2O |
 写出以丙烯和
写出以丙烯和 为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2
为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2| O2 |
| 催化剂 |
| O2 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com