
【题目】大量实验事实表明,对于可逆反应![]() ,在一定温度下,无论反应物的起始浓度如何,反应达到平衡状态后,将各物质的物质的量浓度代入表达式:
,在一定温度下,无论反应物的起始浓度如何,反应达到平衡状态后,将各物质的物质的量浓度代入表达式:![]() (
(![]() 表示物质C的物质的量浓度的p次方。)得到的结果是一个定值。我们把这个常数叫做该反应的化学平衡常数。这个式子叫化学平衡常数表达式。依据你的理解下列可逆反应平衡常数表达式错误的是( )
表示物质C的物质的量浓度的p次方。)得到的结果是一个定值。我们把这个常数叫做该反应的化学平衡常数。这个式子叫化学平衡常数表达式。依据你的理解下列可逆反应平衡常数表达式错误的是( )
化学方程式 | 平衡常数表达式 | |
A |
|
|
B |
|
|
C |
|
|
D |
|
|
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基:![]() +3Fe+6HCl→
+3Fe+6HCl→![]() +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
已知:—CH3为邻、对位取代定位基;而—COOH为间位取代定位基
A.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
B.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
C.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
D.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置对应内容不能完成实验目的是( )
A.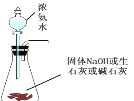 实验室用来快速制取少量氨气的发生装置
实验室用来快速制取少量氨气的发生装置
B.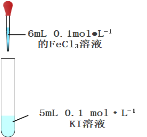 用来探究氯化铁和碘化钾反应限度,反应结束后,加硫氰化钾溶液检测铁离子
用来探究氯化铁和碘化钾反应限度,反应结束后,加硫氰化钾溶液检测铁离子
C.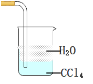 实验室用来吸收尾气氨气的装置
实验室用来吸收尾气氨气的装置
D.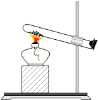 实验室用来制取少量氧气的发生装置,试管内装有氯酸钾和二氧化锰
实验室用来制取少量氧气的发生装置,试管内装有氯酸钾和二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:醛基和双氧水可发生如下反应:
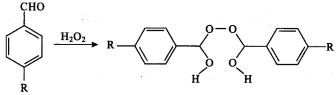
为了合成一类新药,选择了下列合成路线:
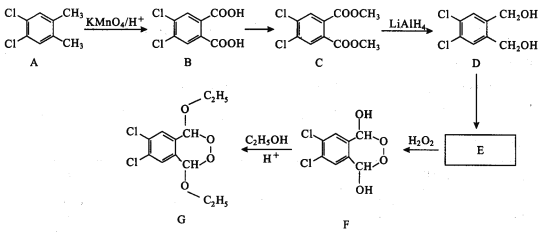
回答下列问题:
(1)C中官能团的名称是_______________________。
(2)E生成F的反应类型是_____________________。
(3)E的结构简式为______________________________。
(4)B生成C的化学方程式为_____________________。
(5)与B互为同分异构体属于芳香二元羧酸,且核磁共振氢谱为两组峰(峰面积比为1:l)的有机物有______种。
(6)设计主要以甲醇和苯甲醇为原料制备 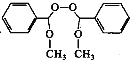 的合成路线_________。
的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容的密闭容器中充入2molA和1molB的气体后发生反应2A(g)+B(g)xC(g),达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为( )
A.1 或2B.2 或3C.3 或4D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7。主要流程如图:
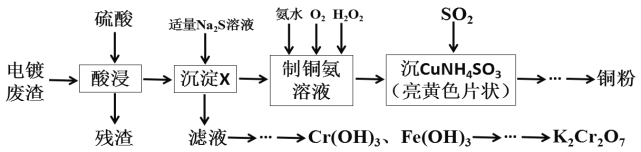
(1)加入适量Na2S溶液后生成的沉淀X为___,若加入的Na2S溶液过量,除生成X外还会发生反应的离子方程式为___。
(2)请配平[Cu(NH3)4]SO4·H2O加热发生分解反应的化学方程式。
___[Cu(NH3)4]SO4·H2O![]() ___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
(3)“沉CuNH4SO3”时可用如图装置(夹持、加热仪器略):
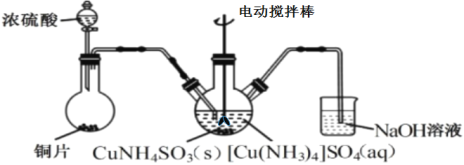
①“沉CuNH4SO3”时,反应温度需控制在45℃,合适的加热方式是___。
②NaOH溶液的作用是___。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250mL溶液,取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol/L硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行三次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为20.00mL,则所得产品K2Cr2O7的纯度为___%。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+,还含有一定浓度的Fe3+,可通过调pH的方法使两者转化为沉淀。假设两种离子初始浓度均为2×10-3mo/L,当溶液中刚开始析出Cr(OH)3沉淀时,c(Fe3+)=___mo/L。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素且原子半径最小,e为金属,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出d元素在周期表中的位置________。
(2)c的单质的分子式为________。
(3)d元素有两种同素异形体,写出其中有气味的一种的分子式________。
(4)b的最简单气态氢化物的结构式是________。
(5)d和e组成的常见化合物是淡黄色固体,写出该化合物电子式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )
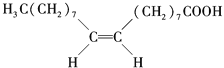
A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com