
【题目】下列有关实验的叙述正确的是( )

A.闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动
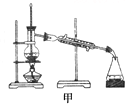
B.将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置
C.用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签
D.配制500 mL 0.4 mol·L-1NaCl溶液,必要的仪器如图乙所示
科目:高中化学 来源: 题型:
【题目】PbO2及2PbCO3·Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料。
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到。
①Pb(NO3)2被氧化为PbO2的离子方程式为 。
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)![]() PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
(2)制备碱式碳酸铅的实验步骤如下:

①“碳化”时,发生反应的化学方程式为 。
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 。
(3)为确定2PbCO3·Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示。
①A→B过程中,从体系中逸出的分解产物(化合物)为 (填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为 (填化学式)。
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制350mL1.0mol/LH2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/L)体积为多少?取25 mL1.0mol/LH2SO4溶液与2g锌粉充分反应,产生标准状况下H2多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2H2O2=2H2O+O2↑,下列措施不能增大化学反应速率的是
A. 减小H2O2溶液的浓度 B. 升高H2O2溶液的温度
C. 向H2O2溶液中加入少量MnO2粉末 D. 向H2O2溶液中加入一定浓度的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300ml 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( )

A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl-、Br-、Fe2+、I-的还原性依次增强。现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如右图所示,请回答:

(1)a、c线分别代表溶液中__________、________(填离子符号,下同)的变化情况;
(2)原溶液中FeI2的物质的量为__________;
(3)原溶液中Fe2+与Br-的物质的量之比为____________;
(4)当通入2mol Cl2时,溶液中离子反应为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com