
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________,基态时该阳离子的价电子排布式为___________。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____元素。
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是________________________________________。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2![]() 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
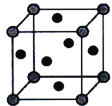
①该铜银合金的化学式是___________________。
②已知:该铜银晶胞参数为acm,晶体密度为ρg·cm-3。
则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为bcm、ccm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=![]() ×100%)
×100%)
【答案】2 3d9 O或氧 Cu失去一个电子后的价层电子排布式为3d10,达到全充满稳定结构;Zn失去一个电子后的价层电子排布式为3d104s1,Zn+4s1上的电子比Cu+3d10上的电子易失去 sp2、sp3 6:1 AgCu3或Cu3Ag ![]()
![]()
【解析】
![]() 、
、![]() 中Cu元素化合价为
中Cu元素化合价为![]() 价,则“中国蓝”、“中国紫”中均具有Cu2+,则
价,则“中国蓝”、“中国紫”中均具有Cu2+,则![]() ,Cu为29号元素,基态时该阳离子的价电子为其3d能级上的9个电子,所以其价电子排布式为
,Cu为29号元素,基态时该阳离子的价电子为其3d能级上的9个电子,所以其价电子排布式为![]() ,故答案为:2;
,故答案为:2;![]() ;
;![]() “中国蓝”的发色中心是以
“中国蓝”的发色中心是以![]() 为中心离子的配位化合物,该配合物中铜离子提供空轨道、O原子提供孤电子对,所以提供孤电子对的是O元素,故答案为:氧
为中心离子的配位化合物,该配合物中铜离子提供空轨道、O原子提供孤电子对,所以提供孤电子对的是O元素,故答案为:氧![]() 或
或![]()
![]() 因为Cu失去1个电子后,会变成稳定的
因为Cu失去1个电子后,会变成稳定的![]() 全满结构,所以Cu较难失去第二个电子,而锌失去两个电子后会变成稳定的
全满结构,所以Cu较难失去第二个电子,而锌失去两个电子后会变成稳定的![]() 全满结构,所以Cu的第二电离能比Zn大,故答案为:Cu失去一个电子后的价层电子排布式为3d10,达到全充满稳定结构;Zn失去一个电子后的价层电子排布式为3d104s1,Zn+4s1上的电子比Cu+3d10上的电子易失去;
全满结构,所以Cu的第二电离能比Zn大,故答案为:Cu失去一个电子后的价层电子排布式为3d10,达到全充满稳定结构;Zn失去一个电子后的价层电子排布式为3d104s1,Zn+4s1上的电子比Cu+3d10上的电子易失去;![]() 乙醛中甲基上的C形成4条
乙醛中甲基上的C形成4条![]() 键,无孤电子对,因此采取
键,无孤电子对,因此采取![]() 杂化类型,醛基中的C形成3条
杂化类型,醛基中的C形成3条![]() 键和1条
键和1条![]() 键,无孤电子对,采取
键,无孤电子对,采取![]() 杂化类型,乙醛分子中碳原子的杂化轨道类型是
杂化类型,乙醛分子中碳原子的杂化轨道类型是![]() 、
、![]() ,单键是
,单键是![]() 键,双键中一个是
键,双键中一个是![]() 键,一个是
键,一个是![]() 键,所以乙醛分子中
键,所以乙醛分子中![]() 键与
键与![]() 键的个数比为
键的个数比为 ![]() ,故答案为:
,故答案为:![]() 、
、![]() ;6:1;
;6:1;![]() 银位于顶点,则每个晶胞中含有银为
银位于顶点,则每个晶胞中含有银为![]() ,铜位于面心,每个晶胞中含有铜为
,铜位于面心,每个晶胞中含有铜为![]() ,所以该铜银合金的化学式是
,所以该铜银合金的化学式是![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;![]() 该铜银晶胞参数为
该铜银晶胞参数为![]() ,晶体密度为
,晶体密度为![]() 。则体积为
。则体积为![]() ,质量
,质量![]() ,
,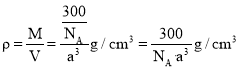 ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;![]() 若Ag、Cu原子半径分别为
若Ag、Cu原子半径分别为![]() 、
、![]() ,则原子总体积=
,则原子总体积=![]() =
= ![]() ,晶胞体积
,晶胞体积![]() ,
,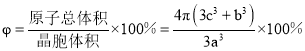 ,故答案为:
,故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)已知:H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1
SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
则硫化氢气体分解为氢气和固体硫的热化学方程式为___。
(2)K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
(已知:H2CO3lgK1=-6.4,lgK2=-10.3;H2SlgKl=-7.0,lgK2=-19.0)。
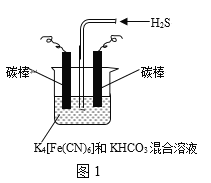
(3)工业上采用图1所示装置电解K4[Fe(CN)6]和KHCO3混合溶液一段时间,然后停止电解,通入H2S,利用生成的K3[Fe(CN)6]将H2S转化为S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___。
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() 。通H2S发生反应的离子反应方程式为___。
。通H2S发生反应的离子反应方程式为___。
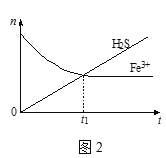
(4)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图2所示。t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是___。
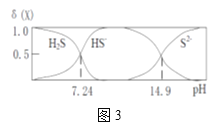
(5)H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图3所示,H2S的电离平衡常数Ka1=___。写出pH由12.0变为16.0时发生的主要的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右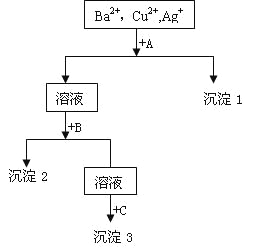
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)当前,产量最高,用途最广的金属是_____________。
(2)这三种金属的金属活动性由强到弱的顺序是_______________ 。
(3)硫酸铁有净水的作用。写出硫酸铁的电离方程式:_____________ 。
(4)小块金属钠投入水中,发生反应的化学方程式为_____________;可观察到的实验现象是_____(填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动d.水变红色
(5)足量的铝与氢氧化钠溶液反应后得到标准状况下的氢气2.24L,则参加反应的铝的质量为_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化关系:
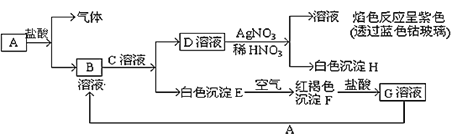
试回答:
(1)写出各物质的化学式A________________、D___________、F_______ 。
(2)检验G溶液中阳离子所选用的试剂是_______(写化学式),实验现象是______。
(3)写出B溶液与C溶液反应的化学方程式___________________________ 。
(4)写出G溶液与A反应的离子反应方程式___________________________ 。
(5)上图中共有6个化学反应,其中属于氧化还原反应的有几个?________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝,工艺流程如图:
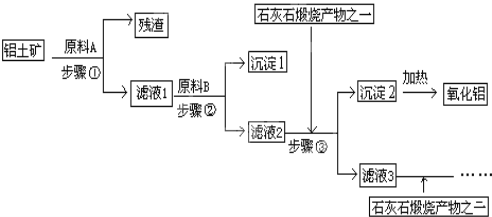
(1)原料A的名称是______,步骤①反应的离子方程式是__________、 ________;
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的子方程式是:________________、 ____________、 _____________;
(3)步骤③主要的化学方程式是:_________;
(4)滤液3中的离子主要有______, 该流程中哪些物质可循环使用_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属(碳、硅、氯、硫、氮等)及其化合物,是构成自然界的重要物质,在人类的生产和生活中有广泛的应用。
(1)a.碳酸钠、b.氯气、c.氢氧化钠、d.二氧化硅、e.盐酸5种物质中:
①属于盐的是___(填序号);
②水晶的主要成分是___;
③水溶液具有漂白性的是___;
(2)碳酸钠溶于水发生电离,其电离方程式为___。
(3)硅酸钠的水溶液俗称水玻璃,向水玻璃中滴加盐酸立刻生成一种凝胶,写出该凝胶的化学式____。
(4)某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为___(用化学方程式表示)。
(5)向H2S 饱和溶液中通入氯气,马上出现了淡黄色浑浊,溶液酸性明显增强,请写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)是一种高强度钢冶炼的添加剂,现某学习小组利用下列装置制备少量氮化镁。
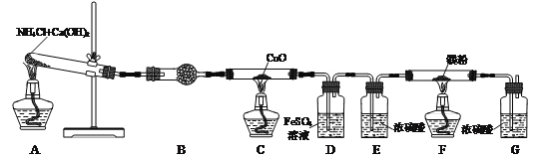
已知:Ⅰ.3Mg+N2![]() Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(1)检查该装置气密性的方法是___。
(2)写出装置A中发生反应的化学方程式:___,装置B中试剂的名称是___。
(3)反应一段时间后装置C中黑色固体变为红色,并有水珠出现。装置C中发生反应的化学方程式为___。
(4)装置D中FeSO4溶液的作用是___。
(5)实验过程中装置A和F应该先加热的是___处。
(6)装置F中有氮化镁生成,写出通过实验验证氮化镁生成的操作及现象:取少量装置F反应后的固体于试管中,___,说明其中含氮化镁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com