
【题目】非金属(碳、硅、氯、硫、氮等)及其化合物,是构成自然界的重要物质,在人类的生产和生活中有广泛的应用。
(1)a.碳酸钠、b.氯气、c.氢氧化钠、d.二氧化硅、e.盐酸5种物质中:
①属于盐的是___(填序号);
②水晶的主要成分是___;
③水溶液具有漂白性的是___;
(2)碳酸钠溶于水发生电离,其电离方程式为___。
(3)硅酸钠的水溶液俗称水玻璃,向水玻璃中滴加盐酸立刻生成一种凝胶,写出该凝胶的化学式____。
(4)某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为___(用化学方程式表示)。
(5)向H2S 饱和溶液中通入氯气,马上出现了淡黄色浑浊,溶液酸性明显增强,请写出该反应的化学方程式____。
【答案】a d b Na2CO3=2 Na++![]() H2SiO3 Cl2+2NaOH=NaCl+NaClO+H2O Cl2+H2S=2HCl+S↓
H2SiO3 Cl2+2NaOH=NaCl+NaClO+H2O Cl2+H2S=2HCl+S↓
【解析】
(1)a. 碳酸钠、b. 氯气、c. 氢氧化钠、d. 二氧化硅、e.盐酸5种物质中:
①碳酸钠属于盐,氯气属于单质,氢氧化钠属于碱,二氧化硅属于氧化物,盐酸属于混合物,答案为:a
②水晶的主要成分是二氧化硅,答案为:d
③氯气溶于水形成的氯水有漂白性,答案为:b
(2)碳酸钠溶于水发生的电离方程式为:Na2CO3=2Na++![]() 。答案为:Na2CO3=2 Na++
。答案为:Na2CO3=2 Na++![]()
(3)硅酸钠和盐酸反应生成的是H2SiO3凝胶,答案为:H2SiO3
(4)NaOH溶液能吸收氯气,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,答案为:Cl2+2NaOH=NaCl+NaClO+H2O
(5)氯气有强氧化性,能将H2S氧化成S:Cl2+H2S=2HCl+S↓。
答案为:Cl2+H2S=2HCl+S↓。


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,反应原理如下图所示。下列说法错误的是
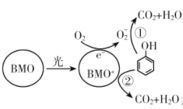
A.苯酚被氧化的总反应:C6H5OH+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.反应过程中BMO表现较强氧化性
C.在酸性条件下,反应①的离子方程式是3C6H5OH+28![]() +28H+=l8CO2↑+23H2O
+28H+=l8CO2↑+23H2O
D.过程①和②中被降解的苯酚的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________,基态时该阳离子的价电子排布式为___________。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____元素。
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是________________________________________。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2![]() 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
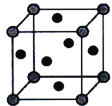
①该铜银合金的化学式是___________________。
②已知:该铜银晶胞参数为acm,晶体密度为ρg·cm-3。
则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为bcm、ccm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1molL-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:

下列说法错误的是( )
A.用NaOH溶液滴定0.1molL-1NaHA溶液可用酚酞作指示剂
B.0.1molL-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.0.1molL-1Na2A溶液中:c(Na+)>c(HA-)+2c(A2-)
D.H2A的Ka2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.50g34%H2O2溶液中含H-O键的数目为NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气已成为城市空气的主要污染源之一,其中的氮氧化物是重要污染物。
(1)汽车内燃机工作时产生NO的原理如图1所示:
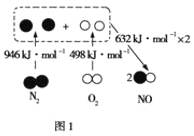
该反应的热化学方程式为______。
(2)治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
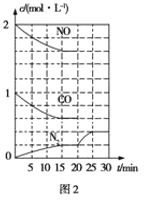
①则从开始到达到平衡状态的过程中,平均反应速率υ(CO2)=____,该温度下反应的平衡常数K=____(结果保留两位有效数字)
②20min时改变的条件可能是____
A.增大压强 C.减小CO2浓度且改用更高效的催化剂
B.降低温度 D.在恒温恒容条件下,充入He气体
③若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将____(填“正向”“逆向”或“不”)移动。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
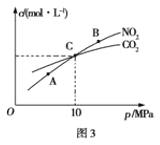
①下列不能说明该反应已达到平衡状态的是_____
a.C的质量不变 b. 混合气体的密度不再发生改变
c. v正(N2)=υ逆(CO2) d.混合气体的颜色不再改变
②计算C点时该反应的平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的合金投入100 mL,一定物质的量浓度的盐酸中,恰好反应,共产生气体5.6 L(标准状况下),向所得溶液中滴加5mol·L-1NaOH溶液至过量,最终产生白色沉淀13.6 g。请计算:
(1)原合金中镁和铝的质量分别是________。
(2)原盐酸溶液的物质的量浓度________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com