
【题目】将一定质量的镁和铝的合金投入100 mL,一定物质的量浓度的盐酸中,恰好反应,共产生气体5.6 L(标准状况下),向所得溶液中滴加5mol·L-1NaOH溶液至过量,最终产生白色沉淀13.6 g。请计算:
(1)原合金中镁和铝的质量分别是________。
(2)原盐酸溶液的物质的量浓度________。
【答案】m(Mg)=2.4 g,m(Al)=2.7 g 5 mol/L
【解析】
金属Mg、Al是比较活泼的金属,与HCl反应产生Mg2+、Al3+进入溶液,Mg2+、Al3+与加入NaOH电离产生的OH-结合形成Mg(OH)2、Al(OH)3,Mg、Al失去电子的物质的量与Mg2+、Al3+形成Mg(OH)2、Al(OH)3结合的OH-的物质的量相等,等于盐酸中的H+完全转化为H2得到的电子的物质的量,结合H2的体积及Mg(OH)2、Al(OH)3沉淀的质量计算。
(1)n(H2)=![]() =0.25 mol,则一定质量的镁和铝的合金反应,转移的电子的物质的量为n(e-)=2n(H2)=2×0.25mol=0.5 mol,向反应后的溶液中加入足量NaOH溶液,Mg2+、Al3+反应产生Mg(OH)2、Al(OH)3,OH-的物质的量等于反应过程中金属失去电子的物质的量,n(OH-)=n(e-)=0.5 mol,则m(OH-)=0.5 mol×17 g/mol=8.5 g,所以Mg、Al质量和为m(Mg、Al)=13.6 g-8.5 g=5.1 g。假设混合物中Mg、Al的物质的量分别是x、y,则24x+27y=5.1;2x+3y=0.5,解得x=0.1,y=0.1,所以混合物中Mg的质量为m(Mg)=0.1 mol×24 g/mol=2.4 g;Al的质量为m(Al)=0.1 mol×27 g/mol=2.7 g;
=0.25 mol,则一定质量的镁和铝的合金反应,转移的电子的物质的量为n(e-)=2n(H2)=2×0.25mol=0.5 mol,向反应后的溶液中加入足量NaOH溶液,Mg2+、Al3+反应产生Mg(OH)2、Al(OH)3,OH-的物质的量等于反应过程中金属失去电子的物质的量,n(OH-)=n(e-)=0.5 mol,则m(OH-)=0.5 mol×17 g/mol=8.5 g,所以Mg、Al质量和为m(Mg、Al)=13.6 g-8.5 g=5.1 g。假设混合物中Mg、Al的物质的量分别是x、y,则24x+27y=5.1;2x+3y=0.5,解得x=0.1,y=0.1,所以混合物中Mg的质量为m(Mg)=0.1 mol×24 g/mol=2.4 g;Al的质量为m(Al)=0.1 mol×27 g/mol=2.7 g;
(2)根据H元素守恒可知n(HCl)=2n(H2)=2×0.25 mol=0.5 mol,则原盐酸溶液的物质的量浓度c(HCl)=![]() =5 mol/L。
=5 mol/L。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】非金属(碳、硅、氯、硫、氮等)及其化合物,是构成自然界的重要物质,在人类的生产和生活中有广泛的应用。
(1)a.碳酸钠、b.氯气、c.氢氧化钠、d.二氧化硅、e.盐酸5种物质中:
①属于盐的是___(填序号);
②水晶的主要成分是___;
③水溶液具有漂白性的是___;
(2)碳酸钠溶于水发生电离,其电离方程式为___。
(3)硅酸钠的水溶液俗称水玻璃,向水玻璃中滴加盐酸立刻生成一种凝胶,写出该凝胶的化学式____。
(4)某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为___(用化学方程式表示)。
(5)向H2S 饱和溶液中通入氯气,马上出现了淡黄色浑浊,溶液酸性明显增强,请写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)是一种高强度钢冶炼的添加剂,现某学习小组利用下列装置制备少量氮化镁。
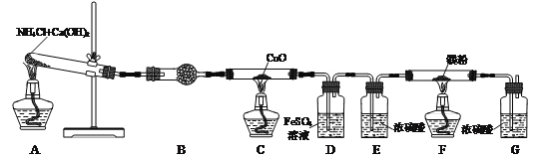
已知:Ⅰ.3Mg+N2![]() Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(1)检查该装置气密性的方法是___。
(2)写出装置A中发生反应的化学方程式:___,装置B中试剂的名称是___。
(3)反应一段时间后装置C中黑色固体变为红色,并有水珠出现。装置C中发生反应的化学方程式为___。
(4)装置D中FeSO4溶液的作用是___。
(5)实验过程中装置A和F应该先加热的是___处。
(6)装置F中有氮化镁生成,写出通过实验验证氮化镁生成的操作及现象:取少量装置F反应后的固体于试管中,___,说明其中含氮化镁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以铁丝和Cl2为原料进行下列三个实验。下列从分类角度分析正确的是
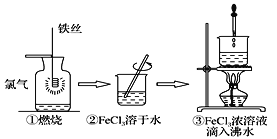
A.实验①、③反应制得的物质均为纯净物
B.③发生化学变化,最终得到的分散系为胶体
C.①反应中铁丝为还原剂,发生还原反应
D.实验①、②涉及的所有物质均为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸被称为“国防化工之母”,某化学兴趣小组对浓硝酸与铜片的反应进行探究,请完成下列问题。
(1)写出反应刚开始阶段化学方程式,并用“双线”桥表达电子转移的方向和数目______________,该阶段反应现象为_________。
(2)最终铜有剩余,则反应将要结束时的离子方程式是________;待反应停止时,再加入稀硫酸,这时铜片上又有气泡产生,其原因是_______。
(3)用试管将反应产生的NO2收集满并倒立在足量的水中,待试管中液面不再上升时,试管中剩余气体的体积约为原气体体积的________(相同条件下)
(4)若12.8g铜与一定质量的浓硝酸反应,铜完全溶解时,产生NO和NO2混合气体共5.6L(标准状况),则反应中转移的电子的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化碳酰胺[CO(NH2)2H2O2]是一种高效、安全的固体消毒剂,白色晶体,易溶于水,稍高温度时可发生分解。某化学小组欲制备少量过氧化碳酰胺,并测定其活性氧的含量,回答下列问题。
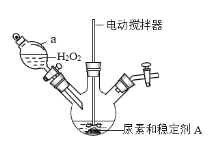
(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是________。
(2)该反应的最佳温度为35℃,采用的合适加热方式为________。
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10molL-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式____________。
(2)过氧化碳酰胺中活性氧含量为_____%。若配制过氧化碳酰胺溶液定容时俯视刻度线,则测得过氧化碳酰胺中活性氧含量______(填“偏高”“偏低”或“无影响”)。
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为________,理由是_____________。
稳定剂名称 | 过氧化碳酰胺活性氧的含量/10-2 | ||||
初始数 | 室温储存30天后数 | 减少量 | 热储存保温1天后数 | 减少量 | |
EDTA | 16.96 | 16.87 | 0.09 | 16.92 | 0.04 |
柠檬酸 | 16.94 | 16.90 | 0.04 | 16.91 | 0.03 |
EDTA与柠檬酸混合物 | 16.95 | 16.90 | 0.05 | 16.90 | 0.05 |
柠檬酸与焦磷酸钠混合物 | 16.90 | 16.86 | 0.04 | 16.87 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.025molBaSO4粉末置于盛有蒸馏水的烧杯中形成1L 悬浊液,然后向烧杯中加入Na2CO3固体(忽略溶液体积的变化)并充分搅拌。加入Na2CO3固体的过程中溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
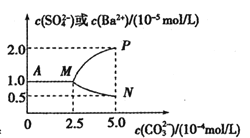
A.常温下,Ksp(BaSO4)=2.5×10-9
B.BaSO4中的溶解度、Ksp均比在BaCl2溶液中的大
C.若要使BaSO4全部转化为BaCO3至少要加入0.65mol Na2CO3
D.BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小关系为:c(![]() )>c(
)>c(![]() )>c(Ba2+)>c(OH-)
)>c(Ba2+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,32 g氧气的体积约为22.4L
B.1.8 g NH4+中含有的质子数为NA
C.常温常压下,48g O3含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为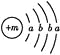 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com