
【题目】硝酸被称为“国防化工之母”,某化学兴趣小组对浓硝酸与铜片的反应进行探究,请完成下列问题。
(1)写出反应刚开始阶段化学方程式,并用“双线”桥表达电子转移的方向和数目______________,该阶段反应现象为_________。
(2)最终铜有剩余,则反应将要结束时的离子方程式是________;待反应停止时,再加入稀硫酸,这时铜片上又有气泡产生,其原因是_______。
(3)用试管将反应产生的NO2收集满并倒立在足量的水中,待试管中液面不再上升时,试管中剩余气体的体积约为原气体体积的________(相同条件下)
(4)若12.8g铜与一定质量的浓硝酸反应,铜完全溶解时,产生NO和NO2混合气体共5.6L(标准状况),则反应中转移的电子的物质的量为_________。
【答案】 铜片溶解,溶液变蓝色,产生红棕色气体。 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 溶液中的硝酸根与硫酸中的氢离子重新具有硝酸的性质,可以继续反应
铜片溶解,溶液变蓝色,产生红棕色气体。 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 溶液中的硝酸根与硫酸中的氢离子重新具有硝酸的性质,可以继续反应 ![]() 0.4 mol
0.4 mol
【解析】
(1)Cu与浓硝酸反应产生Cu(NO3)2、NO2、H2O,根据元素化合价升降总数等于反应过程中电子转移数目用“双线”桥表达电子转移;从固体、液体、气体物质变化分析实验现象;
(2)随着反应的进行,硝酸变为稀硝酸,Cu与稀硝酸发生反应产生硝酸铜、NO、H2O,根据离子方程式书写原则,将化学方程式改写为离子方程式;
(3)根据NO2与H2O反应的方程式,结合反应前后气体体积变化分析判断;
(4)根据金属Cu失去电子的物质的量与硝酸得到电子的物质的量相等计算。
(1)Cu与浓硝酸反应产生Cu(NO3)2、NO2、H2O,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,在该反应中Cu元素化合价升高,失去电子2e-,HNO3中N元素化合价降低,得到电子2e-,用双线桥法表示电子转移为: ;
;
物质Cu与浓硝酸发生反应,会看到铜片逐渐溶解,溶液由无色变蓝色,产生红棕色气体;
(2)随着反应的进行,硝酸变稀,这时是稀硝酸与Cu的反应,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;待反应停止时,若再加入稀硫酸,硫酸电离产生H+,与Cu(NO3)2电离产生的NO3-以HNO3的作用,将Cu氧化,继续发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,因此这时从铜片上又有气泡产生;
(3)用试管将反应产生的NO2收集满并倒立在足量的水中,发生反应:3NO2+H2O=2HNO3+NO,由方程式可知3体积的NO2反应后变为1体积的NO,因此反应后待试管中液面不再上升时,试管中剩余气体的体积约为原气体体积的![]() ;
;
(4)在Cu与硝酸的反应中,Cu失去电子变为Cu(NO3)2,HNO3得到电子变为NO、NO2。在反应过程中电子转移数目相等,所以n(Cu)=![]() =0.2 mol,所以反应过程中电子转移的物质的量n(e-)=2n(Cu)=2×0.2mol=0.4 mol。
=0.2 mol,所以反应过程中电子转移的物质的量n(e-)=2n(Cu)=2×0.2mol=0.4 mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某测定O2含量的传感器工作原理如图所示。O2通过聚四氟乙烯膜进入传感器只与AlI3反应生成Al2O3和I2,RbAg4I5固体只传导Ag+,E为电位计。下列说法错误的是
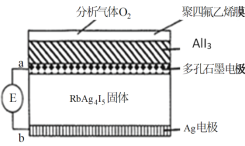
A.电子由a极移动到b极
B.RbAg4I5质量不发生变化
C.b极的电极反应式为:Ag+I--e-=AgI
D.该传感器协同总反应方程式为:3O2+4AlI3+12Ag=2Al2O3+12AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是

A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH*
B.该历程中最大能垒(活化能)为2.16eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02evmol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的合金投入100 mL,一定物质的量浓度的盐酸中,恰好反应,共产生气体5.6 L(标准状况下),向所得溶液中滴加5mol·L-1NaOH溶液至过量,最终产生白色沉淀13.6 g。请计算:
(1)原合金中镁和铝的质量分别是________。
(2)原盐酸溶液的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从钴镍废渣(主要成分为Co2O3、NiS及铁、铝等元素的化合物等杂质)中提取制备锂离子电池的电极材料LiCoO2的工艺如下:
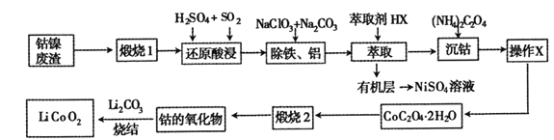
已知:CoC2O4 2H2O 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1) “煅烧1”的主要目的是________________。
(2) “还原酸浸”过程中Co2O3发生反应的离子方程式为 ______________。
(3) “除铁、铝”过程的两种试剂的作用分别是______________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
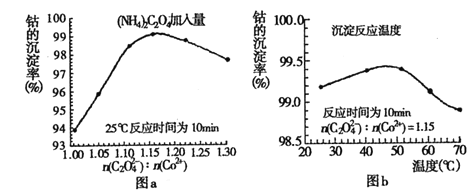
①随n(![]() ):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
②沉淀反应时间为10min,当温度高于50℃以上时,钴的沉淀率下降的原因可能是_______。
(5)为了获得较为纯净的CoC2O42H2O,“操作X”的实验操作为_______________。
(6)已知煅烧CoC2O42H2O时温度不同,产物不同。400℃时在空气中充分煅烧,得到钴的氧化物质量为2.41g,CO2的体积为1.344L(标准状况下),则此时所得钴的氧化物的化学式为____________ 。
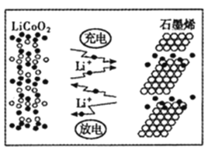
(7)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,我国古代就已经广泛应用了相关的化学知识,下列关于古代化学的应用和记载中,说法不合理的是( )
A.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
B.我国古代人民常用明矾水除去铜器上的铜锈![]()
C.锡青铜![]() 铜锡合金
铜锡合金![]() 文物在潮湿环境中的腐蚀比干燥环境中快
文物在潮湿环境中的腐蚀比干燥环境中快
D.晋代炼丹家、医学家葛洪所著![]() 抱扑子
抱扑子![]() 一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com