
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,32 g氧气的体积约为22.4L
B.1.8 g NH4+中含有的质子数为NA
C.常温常压下,48g O3含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气已成为城市空气的主要污染源之一,其中的氮氧化物是重要污染物。
(1)汽车内燃机工作时产生NO的原理如图1所示:
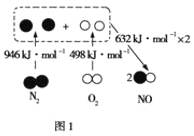
该反应的热化学方程式为______。
(2)治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
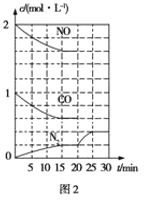
①则从开始到达到平衡状态的过程中,平均反应速率υ(CO2)=____,该温度下反应的平衡常数K=____(结果保留两位有效数字)
②20min时改变的条件可能是____
A.增大压强 C.减小CO2浓度且改用更高效的催化剂
B.降低温度 D.在恒温恒容条件下,充入He气体
③若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将____(填“正向”“逆向”或“不”)移动。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
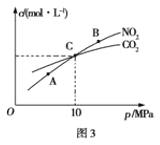
①下列不能说明该反应已达到平衡状态的是_____
a.C的质量不变 b. 混合气体的密度不再发生改变
c. v正(N2)=υ逆(CO2) d.混合气体的颜色不再改变
②计算C点时该反应的平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的合金投入100 mL,一定物质的量浓度的盐酸中,恰好反应,共产生气体5.6 L(标准状况下),向所得溶液中滴加5mol·L-1NaOH溶液至过量,最终产生白色沉淀13.6 g。请计算:
(1)原合金中镁和铝的质量分别是________。
(2)原盐酸溶液的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷是37号元素。根据相关知识回答下列问题:
(1)铷(Rb)位于元素周期表的第________周期________族。
(2)关于铷的结构和性质判断正确的是________(填序号)。
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________(填序号)。
a.Li b.Na
c.K d.Cs
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:① 6.72 L CH4,② 3.01×1023个HCl分子,③ 13.6 g H2S,④ 0.2 mol NH3。下列对这四种气体的描述正确的是( )
A.体积②>③>①>④B.密度 ②<③<④<①
C.质量②>③>④>①D.氢原子个数 ①<③<④<②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
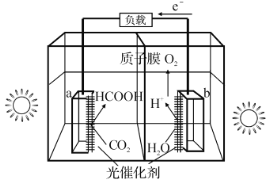
该装置能量转化方式为___。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2 慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2 快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
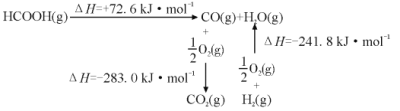
反应CO2(g)+H2(g) HCOOH(g)的焓变△H=___kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___(以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___T1℃时平衡压强(填“>”“<”或“=”),理由是___。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
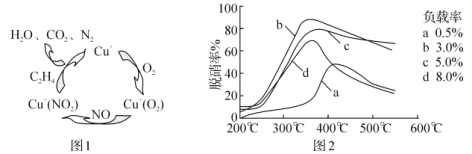
①写出该脱硝原理总反应的化学方程式:___。
②为达到最佳脱硝效果,应采取的条件是___。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___(T℃时甲酸的电离常数为2×10-4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为____________________________________。
(2)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境等密切相关,下列说法不正确的是( )
A.乙醇和汽油都是可再生能源,应大力推广使用“乙醇汽油”
B.铁盐溶于水能生成氢氧化铁胶体,可用作净水剂
C.草木灰![]() 主要成分为
主要成分为![]() 与铵态氮肥
与铵态氮肥![]() 如
如![]() 混用会降低肥效
混用会降低肥效
D.海底可燃冰开发不当释放出的甲烷会造成温室效应的加剧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com