
【题目】甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
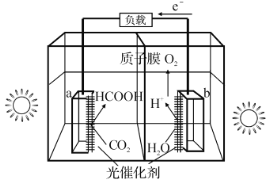
该装置能量转化方式为___。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2 慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2 快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
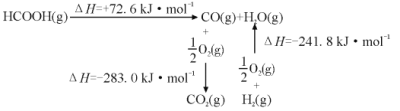
反应CO2(g)+H2(g) HCOOH(g)的焓变△H=___kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___(以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___T1℃时平衡压强(填“>”“<”或“=”),理由是___。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
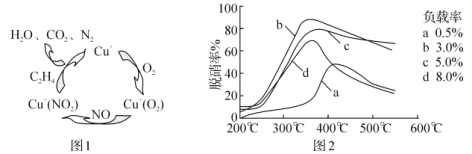
①写出该脱硝原理总反应的化学方程式:___。
②为达到最佳脱硝效果,应采取的条件是___。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___(T℃时甲酸的电离常数为2×10-4)。
【答案】光能转化为化学能和电能 ACD -31.4 0.5k正 > CO2(g)+H2(g) HCOOH(g)为放热反应,温度升高,平衡常数减小,平衡左移,气体的物质的量增加,总压强增大;温度升高,总压强增大 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O 350℃、负载率3.0% 1.6×10-5
3N2+4CO2+4H2O 350℃、负载率3.0% 1.6×10-5
【解析】
(1)根据图示分析能量的转化方式;
(2)根据第一步能够快速平衡,第二步为慢反应,第三步反应为快反应,结合反应方程式和反应速率的影响因素分析判断;
(3)①由图示可知①HCOOH(g)CO (g)+H2O(g)△H=+72.6kJ/mol,②CO(g)+![]() O2(g)=CO2(g)△H= -283.0kJ/mol,③H2(g)+
O2(g)=CO2(g)△H= -283.0kJ/mol,③H2(g)+ ![]() O2(g)=H2O(g)△H= -241.8kJ/mol,再利用盖斯定律分析解答;②反应达到化学平衡时,有v正=v逆,根据速率方程和化学平衡常数表达式分析计算;③根据平衡常数的变化判断平衡移动的方向结合温度的变化分析解答;
O2(g)=H2O(g)△H= -241.8kJ/mol,再利用盖斯定律分析解答;②反应达到化学平衡时,有v正=v逆,根据速率方程和化学平衡常数表达式分析计算;③根据平衡常数的变化判断平衡移动的方向结合温度的变化分析解答;
(4)①根据图1确定反应物、生成物,写出反应方程式;②为达到最佳脱硝效果,需要满足脱硝率高,负载率低,适宜的温度选择合适的条件;
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO-HCOO-+CH3COOH,该反应的平衡常数为12.5,即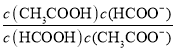 =12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=
=12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=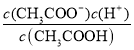 ,据此分析计算。
,据此分析计算。
(1)根据图示,该装置能量转化方式为光能转化为化学能和电能,故答案为:光能转化为化学能和电能;
(2)A.第一步能够快速平衡,第二步为慢反应,因此平衡时v(第一步的逆反应)>v(第二步反应),故A正确;B.根据反应原理,反应的中间产物只有Ru(OOCH)2、RuH2和H2O,故B错误;C.第二步反应为慢反应,说明反应中RuH2与CO2的碰撞仅部分有效,故C正确;D.第三步反应为快反应,说明反应的活化能较低,反应容易进行,故D正确;故答案为:ACD;
(3)由图示可知①HCOOH(g)CO (g)+H2O(g)△H=+72.6kJ/mol,②CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJ/mol,③H2(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol,③H2(g)+![]() O2(g)=H2O(g)△H=-241.8kJ/mol,根据盖斯定律,将①+②-③可得HCOOH(g)CO2 (g)+H2(g) 的焓变△H=(+72.6kJ/mol)+(-283.0kJ/mol)-(-241.8kJ/mol)=+31.4kJ/mol,则CO2(g)+H2(g) HCOOH(g)的焓变△H= -31.4kJ/mol,故答案为:-31.4;
O2(g)=H2O(g)△H=-241.8kJ/mol,根据盖斯定律,将①+②-③可得HCOOH(g)CO2 (g)+H2(g) 的焓变△H=(+72.6kJ/mol)+(-283.0kJ/mol)-(-241.8kJ/mol)=+31.4kJ/mol,则CO2(g)+H2(g) HCOOH(g)的焓变△H= -31.4kJ/mol,故答案为:-31.4;
②反应CO2(g)+H2(g) HCOOH(g)达到化学平衡时,有v正=v逆,即k正c(CO2)c(H2)=k逆c(HCOOH),所以![]() =
=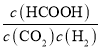 =2,所以k正=2k逆,即k逆=0.5k正,故答案为:0.5k正;
=2,所以k正=2k逆,即k逆=0.5k正,故答案为:0.5k正;
③当温度改变为T2时,k正=1.9k逆,则K=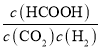 =
=![]() =1.9<2,说明平衡逆向移动,气体的物质的量增大,总压强增大;该反应的正反应为放热反应,温度升高,平衡逆向移动,所以温度T2>T1,温度升高,总压强增大,故答案为:>;CO2(g)+H2(g) HCOOH(g)为放热反应,温度升高,平衡常数减小,平衡左移,气体的物质的量增加,总压强增大;温度升高,总压强增大;
=1.9<2,说明平衡逆向移动,气体的物质的量增大,总压强增大;该反应的正反应为放热反应,温度升高,平衡逆向移动,所以温度T2>T1,温度升高,总压强增大,故答案为:>;CO2(g)+H2(g) HCOOH(g)为放热反应,温度升高,平衡常数减小,平衡左移,气体的物质的量增加,总压强增大;温度升高,总压强增大;
(4)①由图1知,反应物为一氧化氮、氧气、乙烯,铜为催化剂,生成物为氮气、二氧化碳和水,反应的化学方程式为6NO+3O2+2C2H4 ![]() 3N2+4CO2+4H2O,故答案为:6NO+3O2+2C2H4
3N2+4CO2+4H2O,故答案为:6NO+3O2+2C2H4 ![]() 3N2+4CO2+4H2O;
3N2+4CO2+4H2O;
②为达到最佳脱硝效果,需要满足脱硝率高,负载率低,适宜的温度,由图可知,合适的条件为350℃、负载率3%,故答案为:350℃、负载率3%;
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,即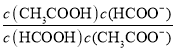 =12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=
=12.5,则该温度下醋酸的电离常数Ka(CH3COOH)= 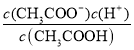 =
=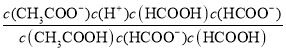 =
=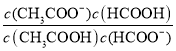 ×
×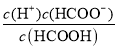 =
=![]() ×2×10-4=1.6×10-5,故答案为:1.6×10-5。
×2×10-4=1.6×10-5,故答案为:1.6×10-5。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)是一种高强度钢冶炼的添加剂,现某学习小组利用下列装置制备少量氮化镁。
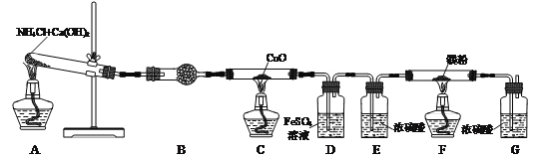
已知:Ⅰ.3Mg+N2![]() Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(1)检查该装置气密性的方法是___。
(2)写出装置A中发生反应的化学方程式:___,装置B中试剂的名称是___。
(3)反应一段时间后装置C中黑色固体变为红色,并有水珠出现。装置C中发生反应的化学方程式为___。
(4)装置D中FeSO4溶液的作用是___。
(5)实验过程中装置A和F应该先加热的是___处。
(6)装置F中有氮化镁生成,写出通过实验验证氮化镁生成的操作及现象:取少量装置F反应后的固体于试管中,___,说明其中含氮化镁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.025molBaSO4粉末置于盛有蒸馏水的烧杯中形成1L 悬浊液,然后向烧杯中加入Na2CO3固体(忽略溶液体积的变化)并充分搅拌。加入Na2CO3固体的过程中溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
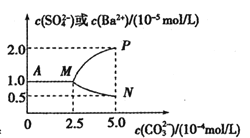
A.常温下,Ksp(BaSO4)=2.5×10-9
B.BaSO4中的溶解度、Ksp均比在BaCl2溶液中的大
C.若要使BaSO4全部转化为BaCO3至少要加入0.65mol Na2CO3
D.BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小关系为:c(![]() )>c(
)>c(![]() )>c(Ba2+)>c(OH-)
)>c(Ba2+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,32 g氧气的体积约为22.4L
B.1.8 g NH4+中含有的质子数为NA
C.常温常压下,48g O3含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知101kPa时的辛烷的燃烧热为5518kJ/mol,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ/mol,则下列热化学方程式书写正确的是
①C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l);△H=+5518kJ/mol;
O2(g)=8CO2(g)+9H2O(l);△H=+5518kJ/mol;
②C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/mol;
O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/mol;
③![]() H2SO4(aq)+Ba(OH) 2(aq)=
H2SO4(aq)+Ba(OH) 2(aq)=![]() BaSO4(s)+H2O(l);△H=﹣57.3kJ/mol;
BaSO4(s)+H2O(l);△H=﹣57.3kJ/mol;
④H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ/mol.
A.①③B.②③C.②④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应3Cl2+6KOH![]() KClO3+5KCl+3H2O,以下说法正确的是( )
KClO3+5KCl+3H2O,以下说法正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.被氧化的氯元素的质量是被还原的氯元素质量的5倍
C.3 mol氯气参加反应转移6 mol电子
D.KOH、KCl和KClO3 都是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为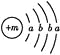 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
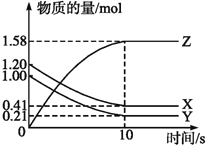
(1)写出该反应的化学方程式__________。
(2)计算反应开始到10 s,用X表示的反应速率是__________,Y的转化率为______。
(3)下列叙述中能说明上述反应达到平衡状态的是____。
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是_____________。
(5)为使该反应的反应速率增大,可采取的措施是______.
a.恒容时充入Ne b.适当升高温度
c.缩小容器的体积 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com