
【题目】关于反应3Cl2+6KOH![]() KClO3+5KCl+3H2O,以下说法正确的是( )
KClO3+5KCl+3H2O,以下说法正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.被氧化的氯元素的质量是被还原的氯元素质量的5倍
C.3 mol氯气参加反应转移6 mol电子
D.KOH、KCl和KClO3 都是电解质
科目:高中化学 来源: 题型:
【题目】某测定O2含量的传感器工作原理如图所示。O2通过聚四氟乙烯膜进入传感器只与AlI3反应生成Al2O3和I2,RbAg4I5固体只传导Ag+,E为电位计。下列说法错误的是
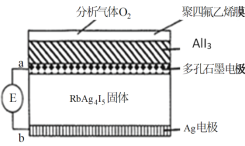
A.电子由a极移动到b极
B.RbAg4I5质量不发生变化
C.b极的电极反应式为:Ag+I--e-=AgI
D.该传感器协同总反应方程式为:3O2+4AlI3+12Ag=2Al2O3+12AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
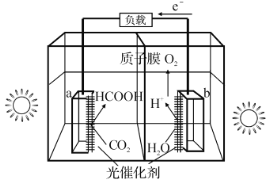
该装置能量转化方式为___。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2 慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2 快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
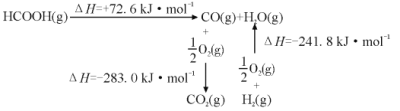
反应CO2(g)+H2(g) HCOOH(g)的焓变△H=___kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___(以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___T1℃时平衡压强(填“>”“<”或“=”),理由是___。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
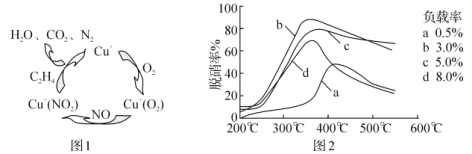
①写出该脱硝原理总反应的化学方程式:___。
②为达到最佳脱硝效果,应采取的条件是___。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___(T℃时甲酸的电离常数为2×10-4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g)![]() CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
A. CO全部转化为乙醇
B. 断4NA个H-H键的同时,生成46g乙醇
C. 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变
D. 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为____________________________________。
(2)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,我国古代就已经广泛应用了相关的化学知识,下列关于古代化学的应用和记载中,说法不合理的是( )
A.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
B.我国古代人民常用明矾水除去铜器上的铜锈![]()
C.锡青铜![]() 铜锡合金
铜锡合金![]() 文物在潮湿环境中的腐蚀比干燥环境中快
文物在潮湿环境中的腐蚀比干燥环境中快
D.晋代炼丹家、医学家葛洪所著![]() 抱扑子
抱扑子![]() 一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
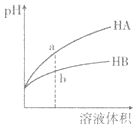
A.水的电离程度:a点小于b点
B.a点溶液的导电性大于b点溶液
C.恰好完全中和时,所需NaOH物质的量:![]()
D.HA的酸性强于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用或现象对应的离子方程式不正确的是
A.用FeCl3溶液腐蚀电路板上的铜:![]()
B.钠浮于水面且能与水剧烈反应:![]()
C.将FeCl3溶液加入滴有淀粉的KI溶液中,溶液变为蓝色:![]()
D.将KOH溶液加入FeCl3溶液中,产生红褐色沉淀:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com