
【题目】下列应用或现象对应的离子方程式不正确的是
A.用FeCl3溶液腐蚀电路板上的铜:![]()
B.钠浮于水面且能与水剧烈反应:![]()
C.将FeCl3溶液加入滴有淀粉的KI溶液中,溶液变为蓝色:![]()
D.将KOH溶液加入FeCl3溶液中,产生红褐色沉淀:![]()
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】关于反应3Cl2+6KOH![]() KClO3+5KCl+3H2O,以下说法正确的是( )
KClO3+5KCl+3H2O,以下说法正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.被氧化的氯元素的质量是被还原的氯元素质量的5倍
C.3 mol氯气参加反应转移6 mol电子
D.KOH、KCl和KClO3 都是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是____。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是____。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净的金属铜的方案。

在能制得纯铜的方案中,哪一步操作会导致环境污染?___。应增加哪些措施防止污染______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
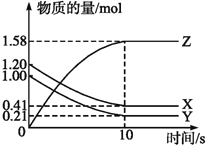
(1)写出该反应的化学方程式__________。
(2)计算反应开始到10 s,用X表示的反应速率是__________,Y的转化率为______。
(3)下列叙述中能说明上述反应达到平衡状态的是____。
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是_____________。
(5)为使该反应的反应速率增大,可采取的措施是______.
a.恒容时充入Ne b.适当升高温度
c.缩小容器的体积 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体(Fe2(SO4)3·2(NH4)2 SO4·3H2O),同时可回收CeO2,工艺流程设计如下
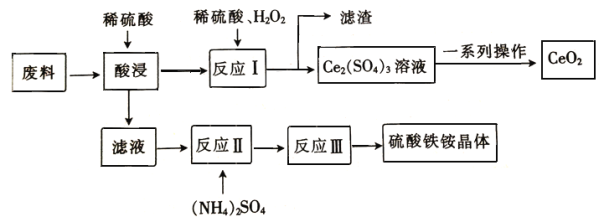
已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________(填化学式)。
(2)“滤液”中含有的阳离子有___________________(填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________(填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知漂白粉溶于水后加入少量的酸能增强漂白效果。某同学据此将少量漂白粉溶于水后,再加入浓盐酸,观察到有黄绿色气体生成。回答下列问题:
(l)写出生成黄绿色气体的离子方程式:_________。
(2)家庭生活中常使用的“84”消毒液和某品牌洁厕净(主要成分为盐酸)____(填“能”或 “不能”)同时使用,其原因是________________
(3)现设计实验由大理石、水、氯气来制取漂白粉:大理石![]() 漂白粉溶液
漂白粉溶液![]() 漂白粉
漂白粉
①在制取漂白粉的实验过程中,请写出发生的氧化还原反应的化学方程式:____。
②当通人氯气较快时,反应产物为Ca(C1O3)2、CaCI2和H2O,请写出此反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能。下列说法中不正确的是
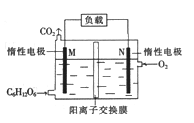
A. M极作负极,发生氧化反应
B. 电子流向:M→负载→N→电解质溶液→M
C. N极的电极反应:O2+4H++4e-=2H2O
D. 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为______;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:2H2(g)+2CO(g)CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为______,随着反应的进行速率逐渐减慢的可能原因是________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com