
【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为______;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:2H2(g)+2CO(g)CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为______,随着反应的进行速率逐渐减慢的可能原因是________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)
【答案】2H2(g)+2CO(g)CH3COOH(l) H=+117.4kJ/mol BD 0.3mol/(L·min) 随着反应的进行反应物浓度降低 1.5 减小 增大
【解析】
(1)用燃烧热的含义和盖斯定律解答;
(2)用勒夏特列原理解答;
(3)用化学反应速率的定义和速率与化学计量数的关系可求用CO表示的速率;用化学平衡常数的含义以及平衡时各物质的浓度求K;用勒夏特列原理和等效平衡理论解释条件改变引起的CH3COOH的体积分数的变化。
(1)根据CO、H2、CH3COOH的燃烧热可写出热化学方程式:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ/mol,②H2(g)+
O2(g)=CO2(g) ΔH=-283.0kJ/mol,②H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ/mol ,③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=-1255.0kJ/mol,用合成气合成CH3COOH(l):①×2+②×2-③可得:2H2(g)+2CO(g)CH3COOH(l) H=(-283.0kJ/mol) ×2+(-285.8kJ/mol) ×2-(-1255.0kJ/mol)= +117.4kJ/mol;
O2(g)=H2O(l) ΔH=-285.8kJ/mol ,③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=-1255.0kJ/mol,用合成气合成CH3COOH(l):①×2+②×2-③可得:2H2(g)+2CO(g)CH3COOH(l) H=(-283.0kJ/mol) ×2+(-285.8kJ/mol) ×2-(-1255.0kJ/mol)= +117.4kJ/mol;
(2) 提高反应2H2(g)+2CO(g)CH3COOH(l)中乙酸的产率,应使平衡正向移动。
A.恒温恒容,通入少量氦气,对反应无影响,不能提高乙酸的产率;
B.及时分离出产物乙酸,可以使平衡正移,从而提高乙酸的产率;
C.催化剂不影响平衡,使用高效催化剂,不能提高乙酸的产率;
D.压缩容器体积,可以使平衡正向移动,从而提高乙酸的产率;
故选BD。
(3)① 0~2min内CH3COOH浓度变化为0.3mol/L,用CH3COOH表示该反应的速率为0.3mol/L÷2min=0.15 mol/(L·min),根据同一反应用不同物质表示的速率之比等于方程式的计量数之比,所以用CO表示该反应的速率为0.15 mol/(L·min)×2=0.3mol/(L·min)。随着反应的进行,反应物浓度降低,速率逐渐减慢;
②平衡时c(CH3COOH)=0.6mol/L ,所以变化的c(CH3COOH)即为0.6mol/L,则变化的CO和H2浓度均为1.2mol/L,起始时c(CO)=c(H2)=4mol÷2L=2mol/L,所以平衡时c(CO)=c(H2)=2mol/L-1.2mol/L=0.8mol/L,该反应的平衡常数K=![]() =
=![]() =1.5;
=1.5;
③平衡后再通入1molH2,可以看做起始时通入的是5molH2和4molCO,由于不是按照方程式的计量数比投料,所以平衡时CH3COOH(g)的体积分数比起始时按方程式的计量数比投料要低;若在恒温恒容时再次通入1molH2和1molCO,则相当于增大压强,平衡会正向移动,所以CH3COOH(g)的体积分数增大。


科目:高中化学 来源: 题型:
【题目】![]() 时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
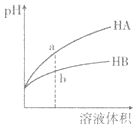
A.水的电离程度:a点小于b点
B.a点溶液的导电性大于b点溶液
C.恰好完全中和时,所需NaOH物质的量:![]()
D.HA的酸性强于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用或现象对应的离子方程式不正确的是
A.用FeCl3溶液腐蚀电路板上的铜:![]()
B.钠浮于水面且能与水剧烈反应:![]()
C.将FeCl3溶液加入滴有淀粉的KI溶液中,溶液变为蓝色:![]()
D.将KOH溶液加入FeCl3溶液中,产生红褐色沉淀:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与水反应生成强碱的是( )
A. NH3 B. Na2O C. CO2 D. NO2
【答案】B
【解析】
A. NH3溶于水生成一水合氨,属于弱碱,A错误;B. Na2O溶于水生成氢氧化钠,是强碱,B正确;C. CO2溶于水生成碳酸,属于弱酸,C错误;D. NO2溶于水生成硝酸和NO,硝酸是强酸,D错误,答案选B。
【题型】单选题
【结束】
19
【题目】利用下列装置可以完成的实验组合是

选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
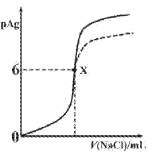
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中可利用反应![]() 来制取氯气。
来制取氯气。
(1)用双线桥(或单线桥)标出反应中电子转移的方向和数目_________。
(2)该反应中氧化剂是_____,氧化产物是________。
(3)若有1 mol KCl完全反应,则转移的电子的物质的量是_____mol,制得标准状况下氯气的体积为____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol
3H2+CO,每消耗1molCH4转移12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸氧钛钡晶体[化学式为BaTi(C2O4)2·4H2O]是制造电子陶瓷原料钛酸钡的重要中间体,可通过以下工艺流程制备。
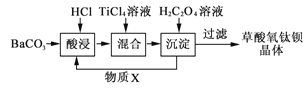
回答下列问题:
(1)酸浸时发生的反应的离子方程式为___;为提高BaCO3的酸浸率,可采取的措施为___(写出一条)。
(2)可循环使用的物质X的电子式为___。
(3)结合流程判断,草酸氧钛钡___(填“能”或“不能”)溶于稀盐酸。
(4)TiCl4(沸点137℃)露置在空气中会迅速与空气中的水反应,有白雾产生,生成的白色二氧化钛粉末用途广泛,写出反应的化学方程式:___。工业上用氯化法制得的粗四氯化钛中常混有SiCl4(沸点57.6℃)、VOCl3(沸点127.2℃),可用___法除去SiCl4;不能用该法除去VOCl3,原因是___。
(5)单质钛是一种性能优异的稀有金属,在军事、航天、医学等领域有广泛用途。以TiCl4和金属镁为原料制取金属钛的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在 20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性 KMnO4 溶液褪色,且有气泡产生。将酸性 KMnO4 溶液换成FeCl3 溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是

A. 20 ℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3 溶液时,产生的气体为Cl2
D. 该条件下H2 燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com