
【题目】![]() 时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
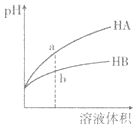
A.水的电离程度:a点小于b点
B.a点溶液的导电性大于b点溶液
C.恰好完全中和时,所需NaOH物质的量:![]()
D.HA的酸性强于HB
【答案】D
【解析】
pH相同的酸,稀释相同倍数时,酸性较强的酸的pH变化大,酸性较弱的酸的pH变化小,据此得出酸性:HA>HB。
A. a点pH大于b点,即a点的c(H+)小于b点,则酸的电离对水的电离的抑制程度:a点小于b点,所以水的电离程度:a点大于b点,A项错误;
B. 在这两种酸溶液中,c(H+)≈c(A),c(H+)≈c(B),而a点的c(H+)小于b点的c(H+),故a点的c(A)小于b点的c(B),即a点的离子浓度小于b点的离子浓度,故a点的导电能力小于b点,B项错误;
C. 在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在稀释前两种酸溶液的浓度:c(HA)<c(HB),故将溶液稀释相同倍数时,酸的浓度仍有:c(HA)<c(HB),故a点酸的总浓度小于b点酸的总浓度,所以二者恰好完全中和,所需NaOH物质的量不一样,C项错误;
D. pH相同的酸,稀释相同倍数时,酸性较强的酸的pH的变化大,酸性较弱的酸的pH的变化小,故HA的酸性强于HB的酸性,D项正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,将0.025molBaSO4粉末置于盛有蒸馏水的烧杯中形成1L 悬浊液,然后向烧杯中加入Na2CO3固体(忽略溶液体积的变化)并充分搅拌。加入Na2CO3固体的过程中溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
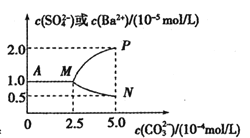
A.常温下,Ksp(BaSO4)=2.5×10-9
B.BaSO4中的溶解度、Ksp均比在BaCl2溶液中的大
C.若要使BaSO4全部转化为BaCO3至少要加入0.65mol Na2CO3
D.BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小关系为:c(![]() )>c(
)>c(![]() )>c(Ba2+)>c(OH-)
)>c(Ba2+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应3Cl2+6KOH![]() KClO3+5KCl+3H2O,以下说法正确的是( )
KClO3+5KCl+3H2O,以下说法正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.被氧化的氯元素的质量是被还原的氯元素质量的5倍
C.3 mol氯气参加反应转移6 mol电子
D.KOH、KCl和KClO3 都是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为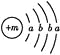 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱。
(1)实验室提纯粗盐的一个重要环节是除去粗盐水中的杂质阳离子(主要含Ca2+、Mg2+),提纯该粗盐时,可考虑在粗盐水中依次加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A____ 、B_____。
(2)氨气分子的空间构型为_____,其中N原子采用_____杂化方式,二氧化碳中心原子C采用_____杂化方式。
(3)上述实验涉及的元素中,Ca基态原子电子排布式为__________________。
(4)上述实验涉及的元素中,O2-、Na+、Cl-中半径最小的是__________。
(5)制取纯碱时,向饱和食盐水中通入气体,即可得到小苏打的沉淀物,氨气与二氧化碳通入的先后顺序是:_________,因为:___________
(6)写成工业上以食盐、氨气、二氧化碳等物质为原料制取小苏打反应的化学方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是____。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是____。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净的金属铜的方案。

在能制得纯铜的方案中,哪一步操作会导致环境污染?___。应增加哪些措施防止污染______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
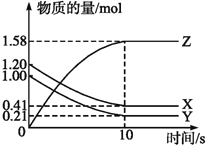
(1)写出该反应的化学方程式__________。
(2)计算反应开始到10 s,用X表示的反应速率是__________,Y的转化率为______。
(3)下列叙述中能说明上述反应达到平衡状态的是____。
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是_____________。
(5)为使该反应的反应速率增大,可采取的措施是______.
a.恒容时充入Ne b.适当升高温度
c.缩小容器的体积 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为______;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:2H2(g)+2CO(g)CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为______,随着反应的进行速率逐渐减慢的可能原因是________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com