
【题目】工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱。
(1)实验室提纯粗盐的一个重要环节是除去粗盐水中的杂质阳离子(主要含Ca2+、Mg2+),提纯该粗盐时,可考虑在粗盐水中依次加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A____ 、B_____。
(2)氨气分子的空间构型为_____,其中N原子采用_____杂化方式,二氧化碳中心原子C采用_____杂化方式。
(3)上述实验涉及的元素中,Ca基态原子电子排布式为__________________。
(4)上述实验涉及的元素中,O2-、Na+、Cl-中半径最小的是__________。
(5)制取纯碱时,向饱和食盐水中通入气体,即可得到小苏打的沉淀物,氨气与二氧化碳通入的先后顺序是:_________,因为:___________
(6)写成工业上以食盐、氨气、二氧化碳等物质为原料制取小苏打反应的化学方程式:______
【答案】Ca(OH)2或CaO Na2CO3 三角锥形 sp3 sp 1s22s22p63s23p64s2 Na+ 先通入氨气后通入二氧化碳 氨气的溶解度较大,且生成的氨水呈碱性,有利于二氧化碳的吸收 NaCl+NH3+H2O+CO2 = NaHCO3↓+NH4Cl
【解析】
(1)要除去粗盐水中的杂质阳离子Ca2+、Mg2+,可在粗盐水中加入沉淀剂Ca(OH)2或CaO(CaO与水反应生成Ca(OH)2,所以实际起作用的还是Ca(OH)2)。将镁离子转化为氢氧化镁沉淀、加入Na2CO3将钙离子转化为碳酸钙沉淀,所以A为Ca(OH)2或CaO、B为Na2CO3;
(2)NH3分子中N原子的价电子对数为![]() ,含有一对孤对电子,分子的空间构型为三角锥形,N原子采用sp3杂化,CO2分子中C原子的价电子对数为
,含有一对孤对电子,分子的空间构型为三角锥形,N原子采用sp3杂化,CO2分子中C原子的价电子对数为![]() ,C原子采用sp杂化;
,C原子采用sp杂化;
(3)Ca的基态原子核外有20个电子,根据核外电子排布规律可得Ca基态原子的电子排布式为1s22s22p63s23p64s2;
(4)Cl-的核外有3个电子层,Na+和O2-的核外均为2个电子层,电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小,则Na+半径最小;
(5)由于氨气的溶解度较大,氨气与水生成的氨水呈碱性,有利于二氧化碳的吸收,因此制取纯碱时,向饱和食盐水中先通入氨气后通入二氧化碳,即可得到小苏打的沉淀物;
(6)工业上制取小苏打(NaHCO3)时,以食盐(NaCl)、氨气和CO2与H2O反应生成NaHCO3和NH4Cl,反应的化学方程式为:NaCl+NH3+H2O+CO2 =NaHCO3↓+NH4Cl。


科目:高中化学 来源: 题型:
【题目】从钴镍废渣(主要成分为Co2O3、NiS及铁、铝等元素的化合物等杂质)中提取制备锂离子电池的电极材料LiCoO2的工艺如下:
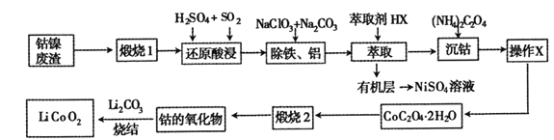
已知:CoC2O4 2H2O 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1) “煅烧1”的主要目的是________________。
(2) “还原酸浸”过程中Co2O3发生反应的离子方程式为 ______________。
(3) “除铁、铝”过程的两种试剂的作用分别是______________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
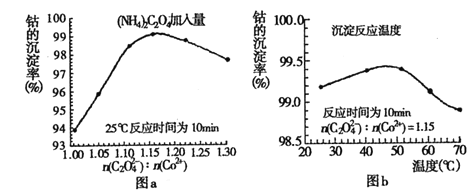
①随n(![]() ):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
②沉淀反应时间为10min,当温度高于50℃以上时,钴的沉淀率下降的原因可能是_______。
(5)为了获得较为纯净的CoC2O42H2O,“操作X”的实验操作为_______________。
(6)已知煅烧CoC2O42H2O时温度不同,产物不同。400℃时在空气中充分煅烧,得到钴的氧化物质量为2.41g,CO2的体积为1.344L(标准状况下),则此时所得钴的氧化物的化学式为____________ 。
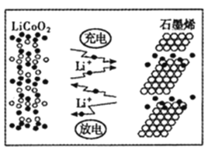
(7)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g)![]() CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
A. CO全部转化为乙醇
B. 断4NA个H-H键的同时,生成46g乙醇
C. 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变
D. 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,我国古代就已经广泛应用了相关的化学知识,下列关于古代化学的应用和记载中,说法不合理的是( )
A.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
B.我国古代人民常用明矾水除去铜器上的铜锈![]()
C.锡青铜![]() 铜锡合金
铜锡合金![]() 文物在潮湿环境中的腐蚀比干燥环境中快
文物在潮湿环境中的腐蚀比干燥环境中快
D.晋代炼丹家、医学家葛洪所著![]() 抱扑子
抱扑子![]() 一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或者结论正确的是( )
A.配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,使用前还要检验是否漏水
B.实验室配制100.0 g,20%的氯化钠溶液,可取20.0 g的NaCl于烧杯中,再加入80.0 mL的水,充分搅拌后即可
C.实验室里需要480 mL 2.0 mol·L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀等步骤进行操作
D.实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,如果在称量时把砝码和硫酸亚铁固体放反(其他操作都正确),则最终溶液浓度会偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
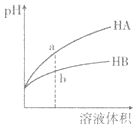
A.水的电离程度:a点小于b点
B.a点溶液的导电性大于b点溶液
C.恰好完全中和时,所需NaOH物质的量:![]()
D.HA的酸性强于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学常见的五种化合物,它们之间有下列转化关系:
![]()
已知A溶液显碱性,焰色反应为黄色,且可促进水的电离。
(1)若A、B、C中含有相同的金属元素,且B为白色沉淀物,则A的化学式为____,D的化学式为_____;A、C反应生成B的离子方程式为___________。
(2)若C是一种无色无味的气体,用离子方程式表示A溶液显碱性的原因___________,C与E反应生成B的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
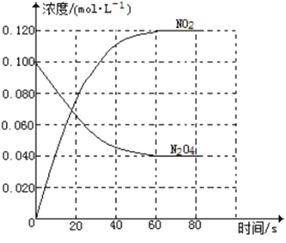
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
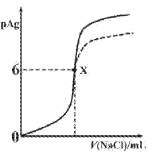
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com