
【题目】已知有以下物质相互转化关系:
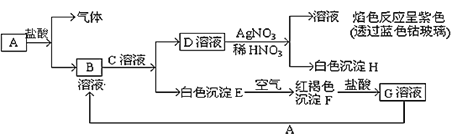
试回答:
(1)写出各物质的化学式A________________、D___________、F_______ 。
(2)检验G溶液中阳离子所选用的试剂是_______(写化学式),实验现象是______。
(3)写出B溶液与C溶液反应的化学方程式___________________________ 。
(4)写出G溶液与A反应的离子反应方程式___________________________ 。
(5)上图中共有6个化学反应,其中属于氧化还原反应的有几个?________ 。
【答案】Fe KCl Fe(OH)3 KSCN 溶液呈红色 FeCl2+2KOH=Fe(OH)2↓+2KCl Fe+2Fe3+=3Fe2+ 3
【解析】
B溶液和C溶液反应生成白色沉淀E,在空气中变成红褐色F,所以E为Fe(OH)2,F为Fe(OH)3,D溶液和AgNO3溶液反应生成白色沉淀为AgCl,得到的溶液的焰色反应呈紫色,说明溶液中有K+,所以B溶液和C溶液是FeCl2和KOH。Fe(OH)3和盐酸反应生成的G溶液为FeCl3溶液,FeCl3溶液和A反应生成B,所以B是FeCl2,A是铁,C即为KOH,A和盐酸反应生成FeCl2和氢气,符合题意。故A为Fe,B为FeCl2,C为KOH,D为KCl,E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,H为AgCl。
由以上分析可知:A为Fe,B为FeCl2,C为KOH,D为KCl,E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,H为AgCl。
(1)化学式A:Fe,D:KCl,F:Fe(OH)3。
(2)检验G(FeCl3)溶液中的Fe3+可选用KSCN溶液,Fe3+和SCN-反应生成红色的配离子和配合物,溶液显红色。
(3)B(FeCl2)溶液与C(KOH)溶液反应的化学方程式为FeCl2+2KOH=Fe(OH)2↓+2KCl。
(4)G(FeCl3)溶液与A(Fe)反应的离子反应方程式为Fe+2Fe3+=3Fe2+。
(5)上图中的6个化学反应,铁和盐酸的置换反应、Fe(OH)2在空气中被氧气氧化为Fe(OH)3的反应以及FeCl3和铁生成FeCl2的归中反应属于氧化还原反应,其他3个都是复分解反应,没有化合价的变化,不是氧化还原反应,所以属于氧化还原反应的共有3个。


科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,下列说法正确的是( )
2CrO42-+2H+,下列说法正确的是( )
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是K=c2(CrO42-)c2(H+)/c(Cr2O72-)c(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列说法正确的是

A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移lmol电子,则消耗1molN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________,基态时该阳离子的价电子排布式为___________。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____元素。
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是________________________________________。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2![]() 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
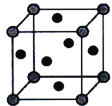
①该铜银合金的化学式是___________________。
②已知:该铜银晶胞参数为acm,晶体密度为ρg·cm-3。
则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为bcm、ccm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com