
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列说法正确的是

A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移lmol电子,则消耗1molN2O
【答案】B
【解析】
A.反应②中碳元素的化合价由+2价变为+4价 ,铁元素的化合价由+3价变为+1价,有元素化合价的升降,因此是氧化还原反应,反应①也是氧化还原反应,故A错误;
B.Fe+作催化剂,使反应的活化能减小,FeO+是反应过程中产生的物质,因此是中间产物,故B正确;
C.由图可知,Fe++N2O=FeO++N2、FeO++CO=Fe++CO2两步中均为反应物总能量大于生成物总能量,所以两个反应都是放热反应,总反应的化学反应速率由速率慢的反应①决定,故C错误;
D.根据反应①N2O+Fe+=N2+FeO+可知,氮元素由N2O→N2,化合价由+1价变为0价,消耗1molN2O,生成1molN2,转移2mol电子,故D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是()
A.H2(g)+![]() O2 (g)=H2O(l) △H=-285.8kJ·mol-1
O2 (g)=H2O(l) △H=-285.8kJ·mol-1
B.H2(g)+![]() O2 (g)=H2O(g) △H=-285.8kJ·mol-1
O2 (g)=H2O(g) △H=-285.8kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ
D.H2+![]() O2=H2O △H=-285.8kJ·mol-1
O2=H2O △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B. 常温常压下,1 mol甲基(-CH3)所含电子数为10NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,11.2L三氯甲烷中含有的极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】JohnB.Goodenough等三位科学家因为在锂离子电池研究领域的突出贡献获得2019年诺贝尔化学奖。碳酸锂是一种常见的锂离子电池原料,一种以锂辉石为原料制取碳酸锂的工艺如图:(锂辉石:LiAl(SiO3)2,也表示为Li2O·Al2O3·4SiO2,还含微量的钠、钙、镁等元素)
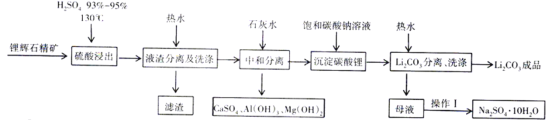
[查阅资料]:Li2CO3为无色单斜晶系结晶体,熔点618℃,溶于硫酸,微溶于水,在冷水中的溶解度比热水中大。
(1)在“硫酸浸出”流程,将硫酸加热到130℃的目的是___________________________。
(2)工业上高温煅烧FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O)的混合物制取电池材料磷酸亚铁锂(LiFePO4),反应的化学方程式为__________________________________。
(3)LiFePO4含有Fe、Li两种金属元素,它们的焰色反应的颜色分别是___________
A.黄色、紫红色B.绿色、黄色C.无焰色反应、紫红色D.黄色、无焰色反应
(4)在“Li2CO3分离、洗涤”流程,用热水洗涤的原因是___________________________。
(5)某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。
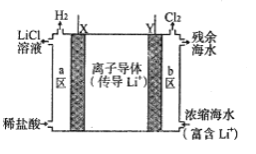
电池中的Y电极为________(填“正极”或“负极”或“阳极”或“阴极”)。X极的电极反应方程式为:________________________________________________。Y极每生成标况下22.4LCl2,有_________molLi+经过离子导体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素是最重要的“成盐元素”,广泛存在于自然界的多种矿物中。
(1)氯的原子结构示意图为______ 。根据氯的原子结构示意图可得出氯的哪些性质 (写出一条)_______ 。
(2)氢气能在氯气中燃烧,观察到的现象为___________ 。
(3)氯气是有毒气体,贮氯罐发生泄漏时可向贮氯罐周围的空气中喷洒稀NaOH溶液。氯气与NaOH反应的化学方程式为____________ 。
(4)水玻璃(硅酸钠的水溶液)中滴入稀盐酸,可生产硅酸胶体,反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化关系:
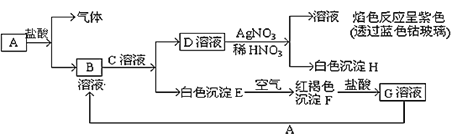
试回答:
(1)写出各物质的化学式A________________、D___________、F_______ 。
(2)检验G溶液中阳离子所选用的试剂是_______(写化学式),实验现象是______。
(3)写出B溶液与C溶液反应的化学方程式___________________________ 。
(4)写出G溶液与A反应的离子反应方程式___________________________ 。
(5)上图中共有6个化学反应,其中属于氧化还原反应的有几个?________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20 L的密闭容器中按物质的量之比为1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
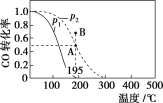
p2及195 ℃ 时n(H2)随时间变化
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A. p1>p2,ΔH<0
B. 在p2及195 ℃ 时,反应前3 min的平均速率v(CH3OH)=0.8 mol·L-1·min-1
C. 在p2及195 ℃ 时,该反应的平衡常数为25
D. 在B 点时,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
相对能量/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。
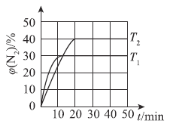
①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择合适的完成指定转化。
试剂:S、CO2、Na2CO3溶液、Na3PO4溶液、K2SO4溶液、浓硝酸、浓盐酸
①K2O(一种碱性氧化物)K2CO3的化学方程式:___;
②PH3PO4的化学方程式:___;
③浓硫酸SO2的化学方程式:___。
(2)根据如图所示物质的转化信息书写相应的反应方程式。

①“反应Ⅱ”为复分解反应,写出该反应的化学方程式:___;
②“反应Ⅰ”的产物之一为NaCl,写出该反应的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com