
【题目】氯元素是最重要的“成盐元素”,广泛存在于自然界的多种矿物中。
(1)氯的原子结构示意图为______ 。根据氯的原子结构示意图可得出氯的哪些性质 (写出一条)_______ 。
(2)氢气能在氯气中燃烧,观察到的现象为___________ 。
(3)氯气是有毒气体,贮氯罐发生泄漏时可向贮氯罐周围的空气中喷洒稀NaOH溶液。氯气与NaOH反应的化学方程式为____________ 。
(4)水玻璃(硅酸钠的水溶液)中滴入稀盐酸,可生产硅酸胶体,反应的离子方程式为_________。
【答案】 强氧化性 氢气在氯气中安静地燃烧,发出苍白色火焰,瓶口出现白雾 Cl2+2NaOH=NaCl+NaClO+H2O SiO32-+2H+=H2SiO3(胶体)
强氧化性 氢气在氯气中安静地燃烧,发出苍白色火焰,瓶口出现白雾 Cl2+2NaOH=NaCl+NaClO+H2O SiO32-+2H+=H2SiO3(胶体)
【解析】
(1)氯原子核内有17个质子,核外有17个电子,分三层排布,其原子结构示意图为 。氯原子最外层有7个电子,在化学反应中容易得到1个电子达到8电子稳定结构,体现强氧化性。
。氯原子最外层有7个电子,在化学反应中容易得到1个电子达到8电子稳定结构,体现强氧化性。
(2)氢气能在氯气中安静地燃烧,发出苍白色火焰,生成的HCl极易溶于水,和空气中的水蒸气结合成盐酸小液滴,在瓶口能观察到白雾。
(3)氯气可以与NaOH反应从而消除氯气的污染,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
(4)水玻璃(硅酸钠的水溶液)中滴入稀盐酸,发生复分解反应,生成硅酸胶体,反应的离子方程式为SiO32-+2H+=H2SiO3(胶体)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
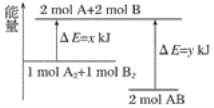
A. 该反应是吸收能量的反应
B. 1molA—A键和1molB—B键断裂能放出xkJ的能量
C. 2molA—B键断裂需要吸收ykJ的能量
D. 2molAB的总能量高于1molA2和1molB2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )
A. 该溶液物质的量浓度为10mol·L-1
B. 该溶液物质的量浓度因溶液的密度未知而无法求得
C. 该溶液中溶质的质量分数因溶液的密度未知而无法求得
D. 所得溶液的体积为22.5L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计如图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题:(提示:C+CO2![]() 2CO C+H2O(g)
2CO C+H2O(g)![]() CO+H2)
CO+H2)

(1)写出装置A中所发生反应的离子方程式:____________。
(2)装置B中最适宜的试剂是________________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是________。
(4)按照如图装置进行实验时,首先进行的操作是__________。
(5)根据实验中的___________现象,可证明CO具有还原性,有关反应的化学方程式是:__________。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在图中装置_____与________之间连接图中的________装置(填序号)。
①![]() NaHCO3溶液 ②
NaHCO3溶液 ② 碱石灰 ③
碱石灰 ③![]() NaOH溶液 ④
NaOH溶液 ④![]() 浓H2SO4
浓H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列装置图回答问题(装置图用符号表示):

(1)双氧水(H2O2)是无色液体,可发生如下化学反应:![]() 。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
(2)KClO3在MnO2作催化剂时,加热也可以制得氧气。应选用的气体发生装置是________。
(3)为了验证MnO2在KClO3分解过程中起到了催化剂作用,我们要把反应后的产物分离,提取出MnO2并验证其的确是催化剂。分离出MnO2的操作有________、________、洗涤、烘干、称量。为证明MnO2是催化剂,还需要知道的一个数据是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列说法正确的是

A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移lmol电子,则消耗1molN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行的可逆反应:aA(g)+bB(g)![]() cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是

A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计蔗糖与浓硫酸反应的实验装置如下,并进行系列实验(必要时可对甲适当加热)。下列说法中正确的是

A.可观察到棉球a、b都褪色,且褪色的原理相同
B.丙、丁中都能观察到有白色沉淀生成
C.实验过程中观察到的系列现象,可验证浓硫酸具有吸水性、脱水性和氧化性
D.m管的作用是平衡压强,戊的作用是吸收尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com