
【题目】1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是()
A.H2(g)+![]() O2 (g)=H2O(l) △H=-285.8kJ·mol-1
O2 (g)=H2O(l) △H=-285.8kJ·mol-1
B.H2(g)+![]() O2 (g)=H2O(g) △H=-285.8kJ·mol-1
O2 (g)=H2O(g) △H=-285.8kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ
D.H2+![]() O2=H2O △H=-285.8kJ·mol-1
O2=H2O △H=-285.8kJ·mol-1
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间
B.工业上用二氧化硅在高温下与焦炭反应可直接制得高纯度的硅
C.氨气在加压时易液化,液氨汽化时吸收大量的热,工业上可使用液氨作制冷剂
D.硫酸亚铁是优良的净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含 Na、Fe、N、O 四种元素。为研究安全气囊工作的化学原理,进行以下实验操作:
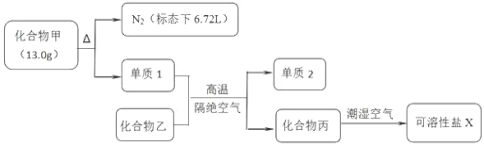
请回答下列问题:
(1)工业上冶炼单质2的化学方程式为 ________;
(2)若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为 ________;
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式 ________。
II.晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl
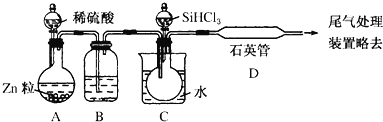
已知①SiHCl3 沸点 33.0℃,上述反应在 1000~1100℃进行;②SiHCl3 能与 H2O 强烈反应,在空气中易自燃。
请回答下列问题:
(1)下列说法不正确的是___________;
A.装置B中的溶液可以是浓硫酸
B.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
C.装置D中观察到的现象是有固体物质生成
D.装置D可以采用普通玻璃管代替石英管
E.为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体
F.尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中
(2)为检验某粗硅中存在的铁元素,可采取的实验操作方法是__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NaClO溶液具有碱性,可用于杀菌消毒
B.NH3具有还原性,可用于检验HCl泄漏
C.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
D.漂白粉在空气中不稳定,可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
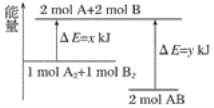
A. 该反应是吸收能量的反应
B. 1molA—A键和1molB—B键断裂能放出xkJ的能量
C. 2molA—B键断裂需要吸收ykJ的能量
D. 2molAB的总能量高于1molA2和1molB2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制100mL1.0mol·L-1的NaCl溶液,试回答下列各题。
(1)经计算,应该用托盘天平称取NaCl固体_________g。
(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是_________(填序号)。
A.锥形瓶,B.200mL容量瓶,C.烧杯,D.胶头滴管,E.药匙,F.托盘天平,G.洗瓶
(3)若要实施配制,除上述仪器外,尚缺的仪器或用品是_________、_________;
(4)在使用前必须检查容量瓶是否______。
(5)配制过程有以下操作:A.移液 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀。其正确的操作顺序应是_________ (填序号)。
(6)下列四项错误操作会导致所得溶液浓度偏高的是______(填序号)。
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(7)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度:______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量。_________________
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8kJ热量。_________________
(3)2molC2H2(g)在O2(g)中完全燃烧生成CO2和H2O(l),放出2598.8kJ热量。_________________。
(4)1molC(石墨)与适量的H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量_________________。
(5)2gH2和足量的O2充分燃烧生成液态水,放出热量为285.8kJ,则H2和O2燃烧的热化学方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列说法正确的是

A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移lmol电子,则消耗1molN2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com