
【题目】I.化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含 Na、Fe、N、O 四种元素。为研究安全气囊工作的化学原理,进行以下实验操作:
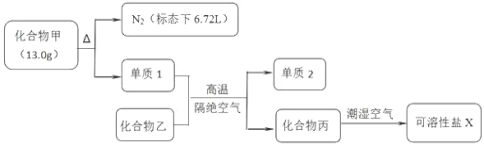
请回答下列问题:
(1)工业上冶炼单质2的化学方程式为 ________;
(2)若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为 ________;
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式 ________。
II.晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl
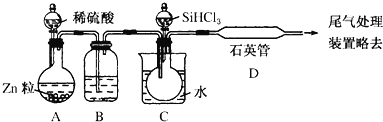
已知①SiHCl3 沸点 33.0℃,上述反应在 1000~1100℃进行;②SiHCl3 能与 H2O 强烈反应,在空气中易自燃。
请回答下列问题:
(1)下列说法不正确的是___________;
A.装置B中的溶液可以是浓硫酸
B.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
C.装置D中观察到的现象是有固体物质生成
D.装置D可以采用普通玻璃管代替石英管
E.为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体
F.尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中
(2)为检验某粗硅中存在的铁元素,可采取的实验操作方法是__________;
【答案】Fe2O3+3CO![]() 2Fe+3CO2 Na2O+2CO2+H2O=2NaHCO3 N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O DF 取样品,先加入足量NaOH 溶液,充分反应后过滤,在滤渣中加入一定量稀硫酸充分反应,在反应后的溶液中滴加氯水,再滴加 KSCN 溶液,若溶液变红, 说明存在 Fe 元素
2Fe+3CO2 Na2O+2CO2+H2O=2NaHCO3 N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O DF 取样品,先加入足量NaOH 溶液,充分反应后过滤,在滤渣中加入一定量稀硫酸充分反应,在反应后的溶液中滴加氯水,再滴加 KSCN 溶液,若溶液变红, 说明存在 Fe 元素
【解析】
I.化合物甲和化合物乙的混合粉末仅含Na、Fe、N、O四种元素,将13.0g化合物甲加热,使其完全分解,生成氮气和单质1,则甲中含有两种元素,其中一种为N元素,单质1在高温隔绝空气的条件下与化合物反应生成化合物丙和另一种单质2,化合物乙应为金属氧化物,应为Fe2O3,生成的另一种单质2为Fe,单质1为Na,化合物丙则为钠的氧化物,能在潮湿的空气中生成可溶性盐,丙为Na2O;氮气物质的量=![]() =0.3mol,氮气的质量=0.3mol×28g/mol=8.4g,故Na元素质量=13g-8.4g=4.6g,Na物质的量=4.6g÷23g/mol=0.2mol,故甲中Na、N原子数目之比=0.2mol:0.3mol×2=1:3,则甲为NaN3;
=0.3mol,氮气的质量=0.3mol×28g/mol=8.4g,故Na元素质量=13g-8.4g=4.6g,Na物质的量=4.6g÷23g/mol=0.2mol,故甲中Na、N原子数目之比=0.2mol:0.3mol×2=1:3,则甲为NaN3;
II.装置A中利用稀硫酸和Zn作用生成的H2,经B中浓硫酸干燥后与D中SiHCl3 生成Si和HCl,尾气可用NaOH溶液吸收,但要有防倒吸措施。
I.由分析知:甲为NaN3、乙为Fe2O3,、单质1为Na、单质2为Fe、化合物丙为Na2O,可溶性盐X可能为Na2CO3或NaHCO3;
(1)工业上利用CO在高温下还原氧化铁来冶炼Fe,发生反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)Na2O在空气中转化为碳酸氢盐,酸式盐为NaHCO3,则反应的化学方程式为Na2O+2CO2+H2O=2NaHCO3;
(3) 30℃时,将水合肼(N2H4H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,可得到 CH3OH和NaN3,则发生反应的化学反应方程式N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O;
II.(1) A.装置B的作用是干燥H2,可以选择浓硫酸,故A正确;
B.SiHCl3沸点为33.0℃,易气化,则可选择用热水浴加热装置C,使滴入烧瓶中的 SiHCl3 气化,有利于和H2充分混合,故B正确;
C.装置D在高温下有Si生成,则观察到的现象是有固体物质生成,故C正确;
D.装置D中反应在 1000~1100℃进行,普通玻璃管会软化或熔化,不能用来代替石英管,故D错误;
E.SiHCl3 能与 H2O 强烈反应,且在空气中易自燃,则为保证制备纯硅实验的成功,除装置气密性好并控制温度外,还需要排尽装置中的空气、干燥气体,故E正确;
F.HCl易溶于水或NaOH溶液,尾气处理装置中不可以将导管直接插入盛有NaOH 溶液的烧杯中,要有防倒吸措施,故F错误;
故答案为DF;
(2)检验某粗硅中存在的铁元素,采取的实验操作方法是取样品,先加入足量NaOH 溶液,充分反应后过滤,在滤渣中加入一定量稀硫酸充分反应,在反应后的溶液中滴加氯水,再滴加 KSCN 溶液,若溶液变红, 说明存在 Fe 元素。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
现有两个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1 molD,800℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中的压强相等B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中C的体积分数比容器Ⅱ中的小D.容器Ⅰ中A的浓度比容器Ⅱ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含氧物质X仅含三种元素,在198℃以下比较稳定,温度高时易分解.,某研究小组设计并完成如下实验:
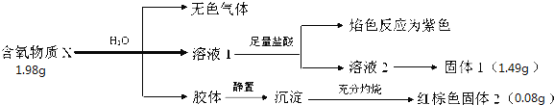
试回答如下问题:
(1)X的化学式为__________,写出X与H2O反应的离子方程式__________________
(2)工业上由红棕色固体2可以制备其单质,写出化学方程式____________________
(3)保存X时应注意_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)△H=-akJ/mol,已知: (a、b、c均大于零)
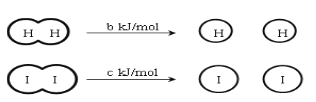
下列说法正确的是
A.碰撞理论认为,反应速率的大小与单位时间内反应物微粒间碰撞次数成正比,只要有足够的能量就可以发生有效碰撞
B.断开2molHI分子中的化学键所需能量约为(c+b+a)kJ
C.相同条件下,1molH2(g)和1molI2(g)总能量小于2molHI(g)的总能量
D.向密闭容器中加入2molH2(g)和2molI2(g),充分反应后放出的热量为2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
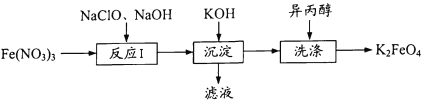
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经高温煅烧NiC2O4制取Ni2O3的流程如图:
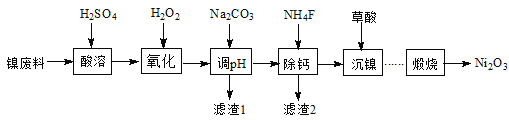
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时硫酸不宜过多的原因为________。
(2)加入H2O2发生的主要反应的离子方程式为________;
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为_________。
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5 mol·L-1],则“除钙”时需控制NH4F的浓度至少为_______mol·L-1。
(5)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为_____。
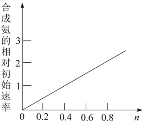
(6)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时,合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是()
A.H2(g)+![]() O2 (g)=H2O(l) △H=-285.8kJ·mol-1
O2 (g)=H2O(l) △H=-285.8kJ·mol-1
B.H2(g)+![]() O2 (g)=H2O(g) △H=-285.8kJ·mol-1
O2 (g)=H2O(g) △H=-285.8kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ
D.H2+![]() O2=H2O △H=-285.8kJ·mol-1
O2=H2O △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B. 常温常压下,1 mol甲基(-CH3)所含电子数为10NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,11.2L三氯甲烷中含有的极性共价键数目为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com