
【题目】JohnB.Goodenough等三位科学家因为在锂离子电池研究领域的突出贡献获得2019年诺贝尔化学奖。碳酸锂是一种常见的锂离子电池原料,一种以锂辉石为原料制取碳酸锂的工艺如图:(锂辉石:LiAl(SiO3)2,也表示为Li2O·Al2O3·4SiO2,还含微量的钠、钙、镁等元素)
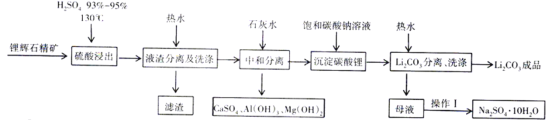
[查阅资料]:Li2CO3为无色单斜晶系结晶体,熔点618℃,溶于硫酸,微溶于水,在冷水中的溶解度比热水中大。
(1)在“硫酸浸出”流程,将硫酸加热到130℃的目的是___________________________。
(2)工业上高温煅烧FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O)的混合物制取电池材料磷酸亚铁锂(LiFePO4),反应的化学方程式为__________________________________。
(3)LiFePO4含有Fe、Li两种金属元素,它们的焰色反应的颜色分别是___________
A.黄色、紫红色B.绿色、黄色C.无焰色反应、紫红色D.黄色、无焰色反应
(4)在“Li2CO3分离、洗涤”流程,用热水洗涤的原因是___________________________。
(5)某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。
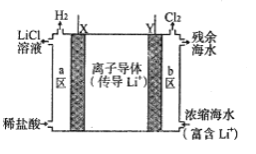
电池中的Y电极为________(填“正极”或“负极”或“阳极”或“阴极”)。X极的电极反应方程式为:________________________________________________。Y极每生成标况下22.4LCl2,有_________molLi+经过离子导体。
【答案】温度升高可加快浸出速率 2FePO4+Li2CO3+H2C2O4.2H2O![]() 2LiFePO4+3CO2↑+3H2O↑ C Li2CO3在冷水中的溶解度比热水中大,热水洗涤可减少Li2CO3的溶解度损耗,提高产率 负极 2H++2e-=H2↑ 2
2LiFePO4+3CO2↑+3H2O↑ C Li2CO3在冷水中的溶解度比热水中大,热水洗涤可减少Li2CO3的溶解度损耗,提高产率 负极 2H++2e-=H2↑ 2
【解析】
根据题意、流程进行分析。锂辉石的主要成分为LiAl(SiO3)2,还含微量的钠、钙、镁等元素,加入硫酸酸浸后过滤,所得滤液中主要含Li2SO4、A12(SO4)3,还含有硫酸、Na+、Mg2+等;加入石灰水将滤液中的硫酸中和、A13+和Mg2+转化为沉淀而除去;过滤后加入饱和碳酸钠溶液使Li+转化成Li2CO3 ,沉淀,据此分析作答。
(1)根据升高温度,增大反应速率,则在“硫酸浸出“流程中,将硫酸加热到130℃是为了加快浸出速率;答案为提高浸出速率。
(2)制取电池材料磷酸亚铁锂(LiFePO4)时,反应物有FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O),生成物为LiFePO4,铁元素的化合价降低,则该过程中某种物质被氧化,根据元素化合价变化规律,可知草酸中的C元素被氧化,由+3价升高为+4价,结合电子守恒和元素守恒可知,产物中还含有CO2和H2O,所以化学方程式为2FePO4+Li2CO3+ H2C2O4·2H2O![]() 2LiFePO4+3CO2↑+3H2O↑;答案为2FePO4+Li2CO3+ H2C2O4·2H2O
2LiFePO4+3CO2↑+3H2O↑;答案为2FePO4+Li2CO3+ H2C2O4·2H2O![]() 2LiFePO4+3CO2↑+3H2O↑。
2LiFePO4+3CO2↑+3H2O↑。
(3)锂元素的焰色反应为紫红色;铁元素无焰色反应;答案为C。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NaClO溶液具有碱性,可用于杀菌消毒
B.NH3具有还原性,可用于检验HCl泄漏
C.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
D.漂白粉在空气中不稳定,可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量。_________________
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8kJ热量。_________________
(3)2molC2H2(g)在O2(g)中完全燃烧生成CO2和H2O(l),放出2598.8kJ热量。_________________。
(4)1molC(石墨)与适量的H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量_________________。
(5)2gH2和足量的O2充分燃烧生成液态水,放出热量为285.8kJ,则H2和O2燃烧的热化学方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计如图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题:(提示:C+CO2![]() 2CO C+H2O(g)
2CO C+H2O(g)![]() CO+H2)
CO+H2)

(1)写出装置A中所发生反应的离子方程式:____________。
(2)装置B中最适宜的试剂是________________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是________。
(4)按照如图装置进行实验时,首先进行的操作是__________。
(5)根据实验中的___________现象,可证明CO具有还原性,有关反应的化学方程式是:__________。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在图中装置_____与________之间连接图中的________装置(填序号)。
①![]() NaHCO3溶液 ②
NaHCO3溶液 ② 碱石灰 ③
碱石灰 ③![]() NaOH溶液 ④
NaOH溶液 ④![]() 浓H2SO4
浓H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,下列说法正确的是( )
2CrO42-+2H+,下列说法正确的是( )
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是K=c2(CrO42-)c2(H+)/c(Cr2O72-)c(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列说法正确的是

A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移lmol电子,则消耗1molN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com