
【题目】下列化学方程式书写错误的是
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:![]()
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 电子排布式
电子排布式![]()
B.在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性
C.金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性
D.某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2.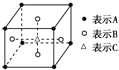
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1molL-1HX溶液中逐滴加入0.2molL-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是( )
A.HX为一元强酸,YOH为一元弱碱
B.M点水的电离程度大于N点水的电离程度
C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(OH-)>c(H+)
D.25℃pH=a时的YX溶液中水电离出的c(H+)=1.0×10-amol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
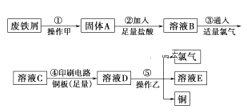
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是_____。
(2)步骤②中,除发生反应Fe+2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O和____。
(3)溶液C的颜色是____,溶液D中可能含有的金属阳离子有___。
(4)可以验证溶液B中是否含有Fe2+的一种试剂是____(填选项序号)。
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(5)操作乙的名称是___,步骤⑤产生金属铜的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO![]() )、c(NO
)、c(NO![]() )和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
)和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有化合物:
甲: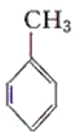 乙:
乙: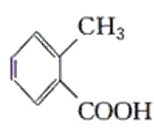 丙:
丙: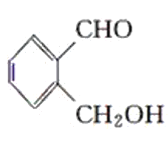
(1)请判别上述哪些化合物互为同分异构体(填序号):____________。
(2)请用一种试剂鉴别甲、乙、丙化合物。在下表中填入所选试剂及主要现象即可。________
试剂 | 现象 | |
甲 | ||
乙 | ||
丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol/L Na2CO3溶液,下列判断不正确的是
A.粒子种类与NaHCO3溶液相同
B.升高温度,c(CO32-)增大
C.加入CaCl2溶液,c(CO32-)减小
D.c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com