
【题目】下列指定反应的离子方程式正确的是
A. 向MgCl2溶液中滴加过量氨水:Mg2++2OH-=Mg(OH)2↓
B. 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO![]() =Ag++NO↑+2H2O
=Ag++NO↑+2H2O
C. 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu=2Fe+3Cu2+
D. 向NaAlO2溶液中通入过量CO2:AlO![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g) +2B(g)![]() C(p)。反应过程中测定的部分数据见下表:
C(p)。反应过程中测定的部分数据见下表:
反应时间/min | n(A)/mol | n(B)/ mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
下列说法错误的是
A. 前10min内反应的平均速率为v(C)=0.0250 mnol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60mo1B气体,到达平衡时,n(C)<0.25mo1
C. 其他条件不变时,向平衡体系中再充入0.50molA,与原平衡相比,达平衡时B的转化率增大,A的体积分数增大
D. 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍与铁,钴相似,在常温下对水和空气都较稳定,能抗碱性腐蚀。常温下,镍即可与一氧化碳反应,形成剧毒的四羰基镍(Ni(CO)4),加热后它又会分解成金属镍和—氧化碳。工业上用含废镍废料(含有铝、铁和有机物)为原料制备兰尼镍的工艺流程如图所示:
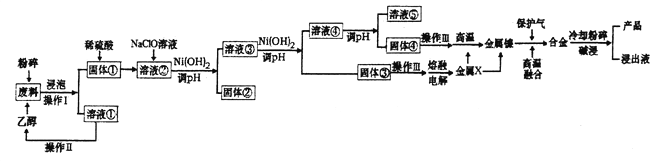
已知:25℃时Ni(OH)2的Ksp=5.4×10-16;Al(OH)3的Ksp=3.0×10-34.
(1)若将NaOH固体进行高温熔融,可选择的坩埚为_________。
a.铁坩埚 b.氧化铝坩埚 c.石英坩埚 d.镍坩埚
(2)操作Ⅱ的名称为__________;实验室中在进行操作III时,仪器除酒精灯、坩埚、三脚架外还缺______________。
(3)加入NaC1O溶液时发生反应的离子反应方程式______________________________。
(4)固体④经操作III得到NiO。合金中铝和镍的物质的量之比为2:3,则前后两份金属铝用量的最佳配比为________________。
(5)25℃时,若测得溶液⑤pH=9,该溶液中c(Ni2+)/c(A13+)=__________。
(6)将金属X与金属镍进行高温融合时,可否用CO做保护气,请说明原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. a—定由W、X两种元素组成
D. 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NO和NO2的叙述正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的物质的量相等
D.NO2可用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
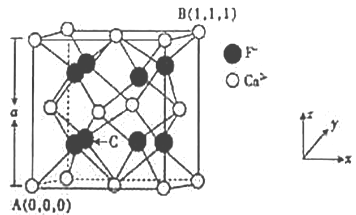
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com