
将不同量的H2O(气) 和CO 气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O (g) + CO( g)  CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
H2O | CO | H2 | CO | |||
1 | 650℃ | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min |
2 | 900℃ | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验1中以v( CO2) 表示的反应速率为__________。
②该反应在650℃时平衡常数数值为__________,该反应的逆反应为__________ (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t <3min,则a、b 应满足的关系是__________。
(2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:

①图1中时刻t2发生改变的条件可能是__________ (写2条)
②图2中时刻t2发生改变的条件可能是__________ (写2条)
(3)在850℃时,其平衡常数K = 1,850℃时在该容器中同时充人1.0moICO,3.0 molH2O,1.0molCO2,5.0molH2,此时反应向__________(填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为__________。
(1)①0.16mol/(L·min) ②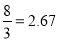 吸 ③b=2a>1 (2)①加入催化剂或缩小容器体积 ②通H2O(g)或降温或减小H2浓度 (3)逆反应 0.8mol 略
吸 ③b=2a>1 (2)①加入催化剂或缩小容器体积 ②通H2O(g)或降温或减小H2浓度 (3)逆反应 0.8mol 略
【解析】
试题解析:(1)①根据方程式计算可得,实验1中达到平衡时CO2的物质的量为0.8 mol。以v(CO2)表示的反应速率为:0.8 mol÷1L÷5 min=0.16 mol·L-1·min-1。②根据K=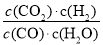 计算可得该反应在650 ℃时平衡常数数值为
计算可得该反应在650 ℃时平衡常数数值为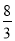 。第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应,其逆反应则为吸热反应。③反应前后气体体积不变,达到相同平衡状态且时间更短,故a、b应满足的关系是:b=2a>1;(2)①图1中t2时刻正逆反应速率同时同等程度增大,平衡不移动,故改变的条件可能是使用催化剂或增大压强;②图2中从t2时刻开始,二氧化碳浓度增大,一氧化碳浓度减小,平衡向正向移动,故改变的条件可能是通H2O(g)或降温或减小H2浓度;(3)850℃时在该容器中同时充人1.0molCO,3.0 molH2O,1.0molCO2,5.0molH2,浓度熵=
。第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应,其逆反应则为吸热反应。③反应前后气体体积不变,达到相同平衡状态且时间更短,故a、b应满足的关系是:b=2a>1;(2)①图1中t2时刻正逆反应速率同时同等程度增大,平衡不移动,故改变的条件可能是使用催化剂或增大压强;②图2中从t2时刻开始,二氧化碳浓度增大,一氧化碳浓度减小,平衡向正向移动,故改变的条件可能是通H2O(g)或降温或减小H2浓度;(3)850℃时在该容器中同时充人1.0molCO,3.0 molH2O,1.0molCO2,5.0molH2,浓度熵=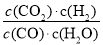 =
=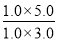 =
=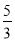 >1,故平衡向逆向移动;设达平衡时消耗nmol二氧化碳,则
>1,故平衡向逆向移动;设达平衡时消耗nmol二氧化碳,则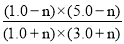 =1,解得n=0.2,故衡时CO2的物质的量为(1-0.2)=0.8nol。
=1,解得n=0.2,故衡时CO2的物质的量为(1-0.2)=0.8nol。
考点:化学反应速率与化学平衡


科目:高中化学 来源: 题型:推断题
利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如下图。
试回答下列有关问题:
(1)“亮菌甲素”的分子式为_______;1 mol“亮菌甲素”跟浓溴水反应时最多消耗_____ mol Br2。
(2)有机物A能发生如下转化。其中G分子中的碳原子在一条直线上。
已知:⑴
⑵R?O?CH3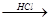 R?OH(R为脂肪烃或芳香烃的烃基)
R?OH(R为脂肪烃或芳香烃的烃基)
①C→D的化学方程式是_________________________________________________;
②G的结构简式是___ ;
③同时符合下列条件的E的同分异构体有 种;
a.遇FeCl3溶液显色;
b.不能发生水解反应,能发生银镜反应;
c.苯环上的一氯取代物只有一种,分子中无甲基
写出其中至少2种的结构简式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上第一次月考化学试卷(解析版) 题型:选择题
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== +890KJ·mol—1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== +890KJ·mol—1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== -890KJ·mol—1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== -890KJ·mol—1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期第一次月考化学试卷(解析版) 题型:选择题
胶体区别于其它分散系的特征是 ( )
A.胶体粒子直径在1-100nm之间 B. 胶体粒子带电荷
C.胶体粒子不能穿过半透膜 D. 胶体粒子能够发生布朗运动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期第一次月考化学试卷(解析版) 题型:选择题
关于胶体和溶液的叙述中正确的是( )
A.胶体带电荷,而溶液呈电中性
B.胶体加入电解质可产生沉淀,而溶液不能
C.胶体是一种非常不稳定的分散系,而溶液是一种非常稳定的分散系
D.胶体能够发生丁达尔现象,而溶液则不能
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二第一学期期中考试化学试卷(解析版) 题型:选择题
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:


下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.H2(g)+ 1/2 O2(g) = H2O(g)的反应热大于△H3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二第一学期期中考试化学试卷(解析版) 题型:选择题
反应NH4HS(s)  NH3(g)+H2S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是
NH3(g)+H2S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是
A.其他条件不变时通入SO2气体 B.移走一部分NH4HS固体
C.容器体积不变,充入NH3 D.压强不变时,充入N2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二第一学期期中考试化学试卷(解析版) 题型:选择题
某实验小组学生按照课本实验要求,用50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎泡沫塑料的作用是固定小烧杯
D.酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高一上学期期中考试化学试卷(解析版) 题型:选择题
等质量的CH4和NH3相比较,下列结论错误的是( )
A、它们的分子个数之比为17:16
B、它们的原子个数之比为17:16
C、它们的氢原子个数之比为17:12
D、它们所含氢的质量比为17:12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com