
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
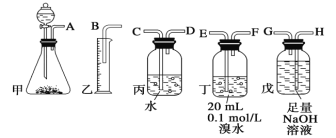
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项);
A. 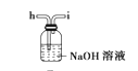
B.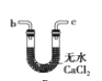
C.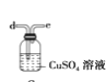
D.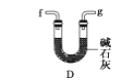
(7)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:纯净乙炔气 ![]() 混合液
混合液 ![]() 有机混合物Ⅰ
有机混合物Ⅰ ![]() 混合液
混合液 ![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
【答案】CaC2+2H2O![]() Ca(OH)2+C2H2↑ AHGEFDCB 饱和食盐水
Ca(OH)2+C2H2↑ AHGEFDCB 饱和食盐水 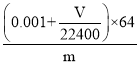 ×100% 偏高 H2S+Br2=S↓+2HBr BD 蒸馏(或分馏) CH2=CHBr、CH3-CHBr2、CH2Br-CH2Br
×100% 偏高 H2S+Br2=S↓+2HBr BD 蒸馏(或分馏) CH2=CHBr、CH3-CHBr2、CH2Br-CH2Br
【解析】
(1)CaC2和水反应生成氢氧化钙和乙炔,化学方程式为:CaC2+2H2O![]() Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O
Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O![]() Ca(OH)2+C2H2↑;
Ca(OH)2+C2H2↑;
(2)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积,所以正确的连接顺序为:AHGEFDCB;
故答案为:AHGEFDCB;
(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
故答案为:饱和食盐水;
(4)溴水与乙炔恰好完全反应生成C2H2Br4,溴单质的物质的量为0.1mol/L×0.02L=0.002mol,消耗的乙炔为:0.001mol,测得排入量筒内液体体积为VmL(标况),则乙炔的体积为Vml,其物质的量为![]() ;
;
所以乙炔的总物质的量为0.001mol+![]() mol,
mol,
由CaC2+2H2O![]() Ca(OH)2+C2H2↑可知CaC2的物质的量0.001mol+
Ca(OH)2+C2H2↑可知CaC2的物质的量0.001mol+![]() mol,质量为(0.001+
mol,质量为(0.001+![]() )×64g;所以电石纯度可表示为
)×64g;所以电石纯度可表示为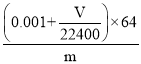 ×100%;
×100%;
故答案为: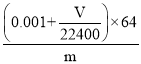 ×100%;
×100%;
(5)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多,最终测得电石的纯度偏高,发生的反应为H2S+Br2=S↓+2HBr;
故答案为:偏高;H2S+Br2=S↓+2HBr;
(6) 干燥乙炔气体主要是除去乙炔中的水分,同时除去混有的少量硫化氢,A和C能除去硫化氢,但是不能除去水。B和D装置都可以吸水,D装置还能除去硫化氢;
答案选BD。
(7)①分离有机物一般是根据其沸点差异,采用蒸馏或分馏方法;
答案为:蒸馏或分馏
②CH≡CH与HBr发生加成反应时,若CH≡CH中断裂一个键,则与HBr加成可得CH2═CHBr,CH2═CHBr能继续与HBr加成得到CH3-CHBr2、BrCH2-CH2Br。
答案为:CH2═CHBr、CH3-CHBr2、CH2Br-CH2Br


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理 NO 尾气通常是将 NO 与 O2 混合通入碱液中吸收。已知一定条件下有下列反应:
Ⅰ:2N2O5(g) ![]() 4NO2(g)+O2(g) △H1
4NO2(g)+O2(g) △H1
Ⅱ:2NO2(g)![]() 2NO(g)+O2(g) △H2
2NO(g)+O2(g) △H2
Ⅲ:2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) △H3
写出 NO 和O2 的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式______。
(2)常温下,NO 极易被 O2 氧化为 NO2,温度高于 423K 时,NO2 发生分解:2NO2(g) ![]() 2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
υ正=υ(NO2)消耗=k 正C2(NO2), υ逆=υ(NO)消耗=2υ(O2) 消耗=k 逆c2(NO)·c( O2),k 正、k 逆 为速率常数,受温度影响。不同温度下,将 NO2 置于体积为 VL 的密闭容器中,NO2 的物质的量的浓度与反应时间的关系如图所示:
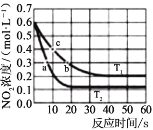
①T1 温度下 0-10s 内,O2 的反应速率υ(O2)=______、平衡常数 KT1=___________。
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采取的单一措施有______
③平衡常数KT1 ______ KT2 填“大于”“小于”或“等于”,下同);反应速率υa_______υb。
④计算 c 处υ正/υ逆=______。
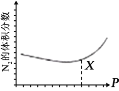
(3)NO 也 可 通 过 如 下 反 应 处 理 :6NO(g)+4NH3(g) =5N2(g) +6H2O(g);一定条件下,平衡时 N2 的体积分数与压强的关系如图所示。N2 的体积分数先减小后增大的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。图是硫元素的常见化合价与部分物质类别的对应关系。
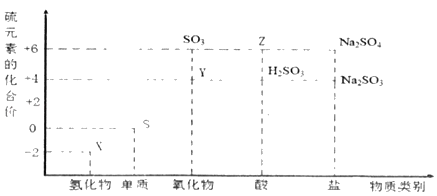
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的氧化物为_____(填化学式)。
(2)将X与Y混合可生成淡黄色固体,该反应的化学方程式为_____。
(3)Z的浓溶液与碳在一定条件下可以发生反应,体现了Z的_____性。
(4)写出硫与浓硫酸在加热条件下反应的化学方程式_____。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方法理论上可行的是_____(填字母)。
a.Na2SO3+S b.Na2S+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 根据以上热化学方程式,下列判断 不 正 确的是
根据以上热化学方程式,下列判断 不 正 确的是
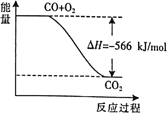
A.上图可表示由CO生成![]() 的反应过程和能量关系
的反应过程和能量关系
B.CO的燃烧热![]()
C.![]()
D.![]() 与
与![]() 反应放出
反应放出![]() 热量时,电子转移数为
热量时,电子转移数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度
B. HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C. 燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D. S(s)+ ![]() O2(g)
O2(g)![]() SO3(g) ΔH=315 kJ·mol1 表示S燃烧热的热化学方程式
SO3(g) ΔH=315 kJ·mol1 表示S燃烧热的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2═2H2O,下列有关说法正确的是( )
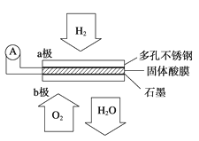
A. 电流通过外电路从a极流向b极
B. b极上的电极反应式为O2+2H2O+4e-═4OH-
C. 每转移0.2 mol电子,在负极上消耗标况下1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
D. 分子式为C9H12的苯的同系物,若苯环上只有一个取代基,则其一溴代物最多有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com