
| A、在卤代烃中直接加入AgNO3溶液 |
| B、加蒸馏水,充分搅拌后,加入AgNO3溶液 |
| C、加入NaOH溶液,加热后加入稀硝酸酸化,再加入AgNO3溶液 |
| D、加入NaOH的乙醇溶液,加热后加入AgNO3溶液 |


科目:高中化学 来源: 题型:
| A、醇和酚都能与氢氧化钠溶液反应 |
| B、醇和酚都能与钠发生反应 |
| C、醇、酚的水溶液都能使石蕊试纸变红 |
| D、醇和酚都能与碳酸钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、AlCl3 溶液中投入过量Na:Al3++4Na+2H2O=AlO2-+4Na++2H2↑ |
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| D、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸乙酯(HCOOC2H5) |
| B、乙酸乙酯(CH3COOC2H5) |
| C、葡萄糖(C6H12O6) |
| D、淀粉〔(C6H10O5)n〕 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 4 |
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 | MnSO4固体 | 0.10mol/LKMnO4溶液 | 褪色时间 |
| 1 | 65℃ | - | - | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | - | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | - | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
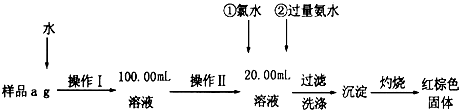
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com