
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如下图所示。

下列说法不正确的是
A. 该催化反应实现了太阳能向化学能的转化
B. 阶段I中,H2O2是氧化产物
C. 每生成1molO2,阶段II中转移电子2 mol
D. 反应的两个阶段均为吸热过程
【答案】D
【解析】
由题给信息可知,利用太阳光实现高效分解水,分两个阶段,阶段I为2H2O=H2O2+H2↑,阶段II为2H2O2=2H2O +O2↑,总反应为2H2O=2H2↑+O2↑,据此分析。
A. 该过程利用太阳光实现高效分解水,实现了太阳能向化学能的转化,故A正确;
B. 阶段I中发生的反应为2H2O=H2O2+H2↑,生成H2O2时氧元素化合价从-2价升高到-1价,所以H2O2是氧化产物,故B正确;
C. 阶段II中发生的反应为2H2O2=2H2O +O2↑,每生成1molO2,转移2 mol电子,故C正确;
D. 过氧化氢不稳定,能量高,分解成的H2O和O2较稳定,所以阶段II发生的反应为放热反应,故D错误。
故答案选D。


科目:高中化学 来源: 题型:
【题目】利用下列反应:Fe+2Fe3+=3Fe2+ 制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式,负极:_____________,正极:__________;装置图:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I现有①BaCl2、②金刚石、③KOH、④Na2SO4、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________(填写物质的序号,下同),熔化时需要破坏共价键的是________。
(2)属于离子化合物的是______________,只有离子键的物质是________。
(3)①的电子式是______________,⑤的电子式是_____________。
II下列粒子(分子或离子)均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离子 | 化合物,双核分子 | 单质, 双核分子 | 化合物,三核分子 | 化合物, 四核分子 | |
请回答下列问题:
(1)A的元素符号是____________,B2-的结构示意图是________。
(2)C的结构式为__________,已知D的单质与水反应可生成氧气及一种酸,写出该反应的化学方程式:________________________________________
(3)E的电子式是____________________;F的水溶液常用于消毒剂,F的化学式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
I.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=_________kJ/mol(用含a、b的代数式表示)
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
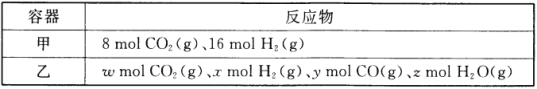
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= _________,此条件下该反应的平衡常数K=_________。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z需满足的关系是_________,且_________ (用含y的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:

则△H_________ 0(填“>”“<”或“=”),压强p1、p 2、p3从大到小的顺序是_________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①![]()
![]() 溶液和
溶液和![]() 溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和![]() 溶液,溶液颜色加深;
溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴![]() 溶液,溶液颜色变浅且出现浑浊;
溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加![]() 溶液
溶液![]() ,溶液颜色先变深后变浅。
,溶液颜色先变深后变浅。
下列分析不正确的是
A. 实验②中增大![]() 浓度使平衡
浓度使平衡![]() 正向移动
正向移动
B. 实验③中发生反应: ![]()
C. 实验③和④中溶液颜色变浅的原因相同
D. 实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是____________(填序号)。
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu-2e-=Cu2+,发生氧化反应

Ⅱ锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(甲)所示.回答下列问题:

(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是_________,电解质的主要成分是__________;
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是______________________。
(2)下图表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属).

①图(乙)中产物的化学式分别为A________,B________;
②操作a中得到熔块的主要成分是K2MnO4.操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑色固体,该反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:
2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:![]() ,判断下列说法正确的是( )
,判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. H2O中H—O 键比HCl中H—Cl键弱
D. 由所提供数据判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾与水反应的实验如下图所示:

(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com