
ЎҫМвДҝЎҝСРҫҝәНЙо¶ИҝӘ·ўCOЎўCO2өДУҰУГ¶Ф№№ҪЁЙъМ¬ОДГчЙз»бҫЯУРЦШТӘөДТвТеЎЈ»ШҙрПВБРОКМвЈә
I.COҝЙУГУЪёЯВҜБ¶МъЈ¬ТСЦӘ
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) ЎчH1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) ЎчH2=bkJ/mol
Фт·ҙУҰFe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)өДЎчH3=_________kJ/mol(УГә¬aЎўbөДҙъКэКҪұнКҫ)
ўт.Т»¶ЁМхјюПВЈ¬CO2әНCOҝЙТФ»ҘПаЧӘ»ҜЎЈ
ЈЁ1Ј©ДіОВ¶ИПВЈ¬ФЪИЭ»эОӘ2LөДГЬұХИЭЖч°ҙјЧЎўТТБҪЦЦ·ҪКҪН¶Ил·ҙУҰОп·ўЙъ·ҙУҰЈәCO2(g)+H2(g) ![]() CO(g)+H2O(g)ЎЈ
CO(g)+H2O(g)ЎЈ
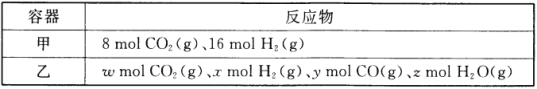
јЧИЭЖч15minәуҙпөҪЖҪәвЈ¬ҙЛКұCO2өДЧӘ»ҜВКОӘ75%ЎЈФт0~15minДЪЖҪҫщ·ҙУҰЛЩВКv(H2)= _________Ј¬ҙЛМхјюПВёГ·ҙУҰөДЖҪәвіЈКэK=_________ЎЈ
УыК№ЖҪәвәуТТУлјЧЦРПаН¬Чй·ЦЖшМеөДМе»э·ЦКэПаөИЈ¬ФтҰШЎўxЎўyЎўzРиВъЧгөД№ШПөКЗ_________Ј¬ЗТ_________ (УГә¬yөДөИКҪұнКҫ)ЎЈ
ЈЁ2Ј©СРҫҝұнГчЈ¬ОВ¶ИЎўС№Зҝ¶Ф·ҙУҰЎ°C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) ЎчHЎұЦРТТұҪөДЖҪәвЧӘ»ҜВКУ°ПмИзПВНјЛщКҫЈә
C6H5CH=CH2(g)+CO(g)+H2O(g) ЎчHЎұЦРТТұҪөДЖҪәвЧӘ»ҜВКУ°ПмИзПВНјЛщКҫЈә

ФтЎчH_________ 0(МоЎ°>ЎұЎ°<Ўұ»тЎ°=Ўұ)Ј¬С№Зҝp1Ўўp 2Ўўp3ҙУҙуөҪРЎөДЛіРтКЗ_________ЎЈ
ЈЁ3Ј©COҝЙұ»NO2Сх»ҜЈәCO+NO2![]() CO2+NOЎЈөұОВ¶ИёЯУЪ225ЎжКұЈ¬·ҙУҰЛЩВКvХэ=kХэЎӨc(CO)ЎӨc(NO2)ЎўvДж=kДжЎӨc(CO2)ЎӨc(NO)Ј¬kХэЎўkДж·ЦұрОӘХэЎўДж·ҙУҰЛЩВКіЈКэЎЈФЪЙПКцОВ¶И·¶О§ДЪЈ¬kХэЎўkДжУлёГ·ҙУҰөДЖҪәвіЈКэKЦ®јдөД№ШПөОӘ_________ЎЈ
CO2+NOЎЈөұОВ¶ИёЯУЪ225ЎжКұЈ¬·ҙУҰЛЩВКvХэ=kХэЎӨc(CO)ЎӨc(NO2)ЎўvДж=kДжЎӨc(CO2)ЎӨc(NO)Ј¬kХэЎўkДж·ЦұрОӘХэЎўДж·ҙУҰЛЩВКіЈКэЎЈФЪЙПКцОВ¶И·¶О§ДЪЈ¬kХэЎўkДжУлёГ·ҙУҰөДЖҪәвіЈКэKЦ®јдөД№ШПөОӘ_________ЎЈ
Ўҫҙр°ёЎҝЈЁb+2aЈ©/3 0.2molЎӨLЈӯ1ЎӨminЈӯ1 1.8 x=2w+y z=y > p1>p2>p3 k=kХэ/kДж
ЎҫҪвОцЎҝ
ўс.ёщҫЭёЗЛ№¶ЁВЙЎчH3=ЈЁЎчH1+2ЎчH2Ј©/3Ј»
ўтЈЁ1Ј©v(H2)=Ўчc/ЎчtЈ»УЙK=c(CO)ЎӨc(H2O)/c(CO2)ЎӨn(H2)јЖЛгЖҪәвіЈКэЈ»
УыК№ЖҪәвәуТТУлјЧЦРПаН¬Чй·ЦЖшМеөДМе»э·ЦКэПаөИЈ¬ФтҰШЎўxЎўyЎўzРиВъЧгөД№ШПө(w-y):(x-y)=8:16јҙx=2w+yЗТz=yЈ»
ЈЁ2Ј©С№ЗҝФҪҙу,ТТұҪөДЖҪәвЧӘ»ҜВКФҪРЎЈ»
ЈЁ3Ј©ҙпЖҪәвКұvХэ=vДжЈ¬јҙkХэЎӨc(CO)ЎӨc(NO2)=kДжЎӨc(CO2)ЎӨc(NO)Ј¬УЙҙЛјЖЛгЎЈ
ўс.ёщҫЭёЗЛ№¶ЁВЙЎчH3=ЈЁЎчH1+2ЎчH2Ј©/3=ЈЁb+2aЈ©/3kJ/molЈ»
ўтЈЁ1Ј©v(H2)=8molx75%/(2LЎБ15min)=0.2mol/(LЎӨmin)ЎЈ
·ҙУҰ8molЎБ75%=6 mol CO2,ФтЖҪәвКұn(CO)=n(H2O)=6molЈ¬n(CO2)=8 mol-6 mol=2 mol, n(H2)=16 mol-6 mol=10 molЈ¬K=c(CO)ЎӨc(H2O)/c(CO2)ЎӨn(H2)=6molx6mol/(2molЎБ10mol)=l.8.
ТӘК№ЖҪәвәуТТУлјЧЦРПаН¬Чй·ЦЖшМеөДМе»э·ЦКэПаөИ,РиВъЧг(w-y):(x-y)=8:16јҙx=2w+yЗТz=yЈ»
ЈЁ2Ј©ОВ¶ИФҪёЯЎўТТұҪөДЖҪҪЦЧӘ»ҜВКФҪҙу,ұнГчЎчH>0Ј»ёГ·ҙУҰөДЎчnЖш>0Ј¬ФтС№ЗҝФҪҙу,ТТұҪөДЖҪәвЧӘ»ҜВКФҪРЎ,№Кp1>p2>p3Ј»
ЈЁ3Ј©ҙпЖҪәвКұvХэ=vДжЈ¬јҙkХэЎӨc(CO)ЎӨc(NO2)=kДжЎӨc(CO2)ЎӨc(NO)Ј¬№КkХэ/kДж=c(CO2)ЎӨc(NO)/c(CO)ЎӨc(NO2)=k



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөИОпЦКөДБҝөДNaәНNa2O2·ЦұрУлЧгБҝөДЛ®·ҙУҰЈ¬ЙъіЙөДЖшМеФЪН¬ОВН¬С№ПВөДМе»эЦ®ұИОӘЈЁ Ј©
A. 1Јә1 B. 1Јә2 C. 2Јә1 D. 2Јә3
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝІЭЛб(H2C2O4)ИЬТәУлЛбРФKMnO4ИЬТә·ҙУҰКұЈ¬ИЬТәНКЙ«ЧЬКЗПИВэәуҝмЈ¬ДіС§П°РЎЧйМҪҫҝ·ҙУҰ№эіМЦРК№НКЙ«јУҝмөДЦчТӘФӯТтЈ¬№эіМИзПВ:
ЎҫІйФДЧКБПЎҝKMnO4ИЬТәСх»ҜH2C2O4өД·ҙУҰАъіМОӘЈә
![]()
ЎҫМбіцјЩЙиЎҝјЩЙи1:ёГ·ҙУҰОӘ·ЕИИ·ҙУҰ
јЩЙи2:·ҙУҰЙъіЙөДMn2Ј«¶ФёГ·ҙУҰУРҙЯ»ҜЧчУГ
јЩЙи3:KЈ«¶ФёГ·ҙУҰУРҙЯ»ҜЧчУГ
ёГРЎЧйН¬С§ОҙМбіцЕЁ¶ИК№·ҙУҰЛЩВКјУҝмөДјЩЙиЈ¬ФӯТтКЗ ЎЈ
ЎҫЙијЖЎўНкіЙКөСйЎҝЈЁ1Ј©іЖИЎ gІЭЛбҫ§Ме(H2C2O4ЎӨ2H2O)Ј¬ЕдЦГ500 mL 0.10 mol/L H2C2O4ИЬТәЎЈ
ўЩФЪЙПКц№эіМЦРұШРлУГөҪөД2ЦЦ¶ЁБҝТЗЖчКЗНРЕММмЖҪәН ЎЈ
ўЪПВБРІЩЧч»бК№ЛщЕдИЬТәЕЁ¶ИЖ«өНөДКЗ (МоПВБРСЎПоөДЧЦДёРтәЕ)ЎЈ
AЈ®іЖИЎІЭЛбҫ§МеКұЈ¬Ҫ«ІЭЛбҫ§Ме·ЕФЪНРЕММмЖҪУТЕМ |
BЈ®¶ЁИЭКұё©КУҝМ¶ИПЯ |
CЈ®Ҫ«ЙХұӯЦРИЬТәЧӘТЖөҪИЭБҝЖҝЦ®З°Ј¬ИЭБҝЖҝЦРУРЙЩБҝХфБуЛ® |
DЈ®ТЎФИәуЈ¬·ўПЦИЬТәТәГжөНУЪҝМ¶ИПЯЈ¬БўјҙУГҪәН·өО№ЬјУЛ®ФЩ¶ЁИЭ |
ЈЁ2Ј©НкіЙМҪҫҝЈ¬јЗВјКэҫЭ
КөСй | ЙХұӯЦРЛщјУКФјБј°УГБҝ(mL) | ҝШЦЖМхјю | ИЬТәНКЙ«Кұјд(s) | |||
0.10 mol/L | өИЕЁ¶И | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | Л®ФЎҝШЦЖОВ¶И65 Ўж | 15 |
3 | 30 | 20 | 30 | 20 | јУИлЙЩБҝMnSO4№ММе | 3.6 |
4 | 30 | 20 | x | 20 | јУИл5 mL 0.10 mol/LK2SO4ИЬТә | 18 |
Фтx = Ј¬јЩЙи2іЙБў
ЈЁ3Ј©УЙУЪKMnO4ДЬСх»ҜЛ®ЦРУР»ъОпөИТтЛШЈ¬ОӘЕдЦЖәГОИ¶ЁөДKMnO4ИЬТәЈ¬ЖдЕЁ¶ИРиұк¶ЁЎЈИЎ10.00 mL 0.10 mol/L H2C2O4ИЬТәУЪЧ¶РОЖҝЦРЈ¬јУИл10 mL 0.50 mol/LПЎБтЛбЈ¬УГЈЁ2Ј©ЦРKMnO4ИЬТәөО¶ЁЦБЧ¶РОЖҝЦРЗЎәГіКЗіЧПЙ«Ј¬ЗТ°л·ЦЦУІ»НКЙ«Ј¬јЗВјКэҫЭЈ¬ЖҪРРИэҙОКөСйЈ¬ЖҪҫщПыәДKMnO4ИЬТә40.00 mLЈ¬ФтІЭЛбИЬТәУлЛбРФKMnO4ИЬТә·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә ЎЈЙПКцКөСйЦРKMnO4ИЬТәөДОпЦКөДБҝЕЁ¶ИОӘ ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРөДФӯЧУ»тФӯЧУНЕІ»КфУЪУР»ъ№ЩДЬНЕөДКЗЈЁ Ј©
A.NO3-B.ЎӘCOOHC.ЎӘOHD.ЎӘCHO
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР·ЦЙўПөЦРЈ¬·ЦЙўЦКОўБЈЦұҫ¶ЧоРЎөДКЗЈЁ Ј©
A.ЗвСх»ҜМъҪәМеB.ө°°ЧЦКИЬТә
C.КҜ»ТИйD.ПхЛбјШИЬТә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРұд»ҜКфУЪ»ҜС§ұд»ҜөДКЗ
A. Хф·ў B. Йэ»Ә C. ЭНИЎ D. ·з»Ҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЦР№ъ»ҜС§јТСРҫҝөДТ»ЦЦРВРНёҙәП№вҙЯ»ҜјБ[МјДЙГЧөг(CQDs)/өӘ»ҜМј(C3N4)ДЙГЧёҙәПОп]ҝЙТФАыУГМ«Сф№вКөПЦёЯР§·ЦҪвЛ®Ј¬ЖдФӯАнИзПВНјЛщКҫЎЈ

ПВБРЛө·ЁІ»ХэИ·өДКЗ
A. ёГҙЯ»Ҝ·ҙУҰКөПЦБЛМ«СфДЬПт»ҜС§ДЬөДЧӘ»Ҝ
B. ҪЧ¶ОIЦРЈ¬H2O2КЗСх»ҜІъОп
C. ГҝЙъіЙ1molO2Ј¬ҪЧ¶ОIIЦРЧӘТЖөзЧУ2 mol
D. ·ҙУҰөДБҪёцҪЧ¶ОҫщОӘОьИИ№эіМ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКТОВПВЈ¬Пт100 mL 0.1 mol/L NH4ClИЬТәЦРјУИлПВБРОпЦКЎЈУР№ШҪбВЫХэИ·өДКЗ
јУИлөДОпЦК | ҪбВЫ | |
A | 100 mL0.1 mol/LСОЛб | ИЬТәЦР2c(NH4+)ЈҪ c(ClЈӯ) |
B | 0.01 mol Na2O2№ММе | ·ҙУҰНкИ«әуЈ¬ИЬТәpHФцҙуЈ¬c(Na+)ЈҪ 2c(ClЈӯ) |
C | 100 mL H2O | УЙЛ®өзАліцөДc(H+)ЎӨc(OHЈӯ)ұдҙу(ҫщЧФУЙАлЧУ) |
D | 100 mL 0.1 mol/L°ұЛ® | ИЬТәЦР |
A. A B. B C. C D. D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ЕҙъУР»рЙХҝЧИёКҜБ¶Нӯ(јУИлМҝ)әНКӘ·ЁБ¶Нӯ(ФЪИЬТәЦРјУМъ)Ј¬ПВБРУР№ШЛө·ЁІ»ХэИ·өДКЗ(ЎЎЎЎ)
A. »рЙХҝЧИёКҜБ¶Нӯ·ўЙъөД·ҙУҰУРCu2(OH)2CO3![]() 2CuOЈ«CO2ЎьЈ«H2O
2CuOЈ«CO2ЎьЈ«H2O
B. »рЙХҝЧИёКҜБ¶Нӯ·ўЙъөД·ҙУҰУР2CuOЈ«C![]() CO2ЎьЈ«2Cu
CO2ЎьЈ«2Cu
C. КӘ·ЁБ¶Нӯ·ўЙъөДЦчТӘ·ҙУҰОӘFeЈ«Cu2Ј«===CuЈ«Fe2Ј«
D. БҪЦЦБ¶НӯөД·Ҫ·ЁЙжј°өДЦчТӘ·ҙУҰ¶јКЗСх»Ҝ»№Фӯ·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com