
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________(写化学式)。
(2)CO可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ/mol
己知:2H2(g)+O2(g)═2H2O(l) △H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g) △H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g)![]() CO(g) +2H2O(g)的反应热△H=___________________。
CO(g) +2H2O(g)的反应热△H=___________________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)![]() CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为 CH3COOCu(NH3)2(aq)+CO(g)![]() CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
【答案】 CO、N2 285.8 -392.8kJ/mol AD 升温或减压
【解析】(1)N2、CO、CO2、H2O中的电子数分别为14、14、22和10个,故氮气和CO为等电子体,故答案为:N2、CO;
(2)①根据燃烧热概念,结合热化学方程式,2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ/mol,氢气的燃烧热为:H2(g)+ ![]() O2(g)=H2O (l)△H=-285.8kJ/mol,所以氢气的燃烧热为285.8kJ/mol,故答案为:285.8;
O2(g)=H2O (l)△H=-285.8kJ/mol,所以氢气的燃烧热为285.8kJ/mol,故答案为:285.8;
②(1)CO(g)+2H2(g)CH3OH(g)△H=-90.8kJ/mol,(2)H2(g)+ ![]() O2(g)=H2O(g)△H=-241.8kJ/mol;
O2(g)=H2O(g)△H=-241.8kJ/mol;
(2)×2-(1)得到:CH3OH(g)+O2(g)CO(g)+2H2O(g)△H=-392.8 kJ/mol,故答案为:-392.8kJ/mol;
②恒温恒容的容器内进行反应CO(g)+2H2(g)CH3OH(g)。A、平衡状态各组分的含量不变,证明反应达到平衡,故A正确;B、氢气和一氧化碳的起始量和消耗量决定,容器中H2浓度与CO浓度相等不能证明反应达到平衡,故B错误;C、混合气体的密度=![]() ,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故C错误;D、化学反应速率之比等于化学方程式中计量数之比,CO的生成速率与CH3OH的生成速率相等,说明正逆反应速率相同,故D正确;故答案为:AD;
,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故C错误;D、化学反应速率之比等于化学方程式中计量数之比,CO的生成速率与CH3OH的生成速率相等,说明正逆反应速率相同,故D正确;故答案为:AD;
(3)CH3COOCu(NH3)2 (aq)+CO(g)CH3COOCu(NH3)2CO(aq)△H<0,反应是气体体积减小的放热反应,故升高温度或减小压强均可以使平衡左移从而实现CO与吸收液的分离,故答案为:升温或减压。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了探究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂进行了如下实验,请填写下列空白:
试剂:5%H2O2 溶液,10%H2O2 溶液,1mol·L-1FeCl3 溶液
仪器: 试管、胶头滴管、酒精灯
(1)实验目的:探究温度对化学反应速率的影响
实验步骤:分别向A、B 两支试管中加5 mL 5 % H2O2溶液,将试管A 放入5℃ 水浴中,将试管B 放入40℃水浴中,同时分别向两试管中加入2~3 滴1mol·L-1FeCl3 溶液,观察实验现象。
实验现象:试管_________(填A 或B)中产生气泡的速率快,说明_________________。
(2)实验目的:探究浓度对化学反应速率的影响
实验步骤:向试管A 中加入5 mL5%H2O2溶液,向试管B 中加入5 mL10%H2O2溶液,观察实验现象。
实验现象:试管A、B 中均有少量气体缓慢产生。
请你改进实验方案,使该实验的实验现象更为明显,以支撑“浓度改变会影响化学反应速率”这一理论预测。______________________________________
(3)实验目的:____________________________。
实验步骤:分别向试管A 和B 中加入5 mL 5%H2O2溶液后,再向试管B 中加入1mol·L-1FeCl3 溶液,观察实验现象。
你认为方案(3) 的设计是否严谨?_______(填是或否),说明理由___________________。
(4)下列有关影响化学反应速率的因素的说法错误的是__________(填字母)。
a.对于已经达到化学平衡状态的反应A(g)![]() B(g)+C(g) △H >0,其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,所以平衡正向移动
B(g)+C(g) △H >0,其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,所以平衡正向移动
b.其他条件不变时,增大压强一定能加快化学反应速率
c.其他条件不变时,使用正催化剂,活化分子百分数增大,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在燃烧2.24L(标准状况)CO与O2的混合气体时,放出11.32kJ的热量,最后产物的密度为原来气体密度的1.25倍,则CO的燃烧热为
A. 283 kJ·mol-1 B. -283 kJ·mol-1 C. -566 kJ·mol-1 D. 566kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是

A. x=4
B. 若N中气体的密度如图Ⅲ所示,则A、B可能都是气态
C. 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( ) 
A.其分子式为C25H20
B.分子内的所有碳原子可能共平面
C.完全燃烧生成CO2和H2O的物质的量之比为5:2
D.此分子的一氯代物有三种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( ) 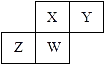
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素Y,Z形成的化合物是制造光电池的主要材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学品要在包装上印有警示性标志,下列化学品的名称与警示性标志名称对应正确的是
A. 烧碱---爆炸品 B. 浓硫酸---剧毒品 C. 汽油---腐蚀品 D. 酒精---易燃品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2min内,用NO表示该反应的平均速率v(NO)=molL﹣1min﹣1 .
(2)该反应的化学方程式是 .
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 .
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
①a处通入的物质是 , 电极反应式为:;
②b处电极反应式为;
③电池工作时H+由极移向极(填正、负极).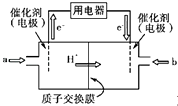
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象,所得结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中含有SO |
B | 将蘸有浓氨水的玻璃棒靠近蘸有某溶液的玻璃棒 | 有白烟产生 | 该溶液是浓盐酸 |
C | 将某气体通入品红溶液中 | 溶液红色褪去 | 该气体可能是SO2 |
D | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中不含NH |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com