
【题目】下列装置正确且能达到对应实验目的的是
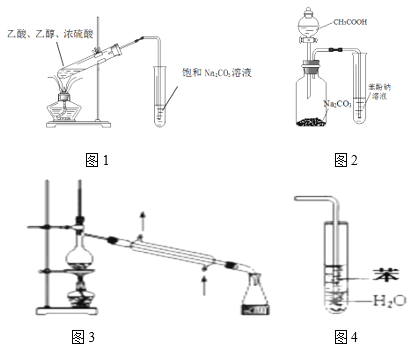
A. 用图1装置制备乙酸乙酯
B. 用图2装置比较乙酸、碳酸、苯酚的酸性强弱
C. 图3常用于分离熔沸点不同的液体混合物
D. 图4可用于吸收HCl气体,并防止倒吸
科目:高中化学 来源: 题型:
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1 mol/L | 1 mol/L |
A. 向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B. 为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C. ①、③混合后发生反应:Mg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3·H2O(aq)
Mg2+(aq)+2NH3·H2O(aq)
D. 向①中加入②,H+与OH—反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/mol·L-1 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)写出醋酸的电离方程式:__________________________。
(2)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________________。
(3)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为____
(4)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___________mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=______________mol/L。
(5)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(6)室温时醋酸的电离常数Ka=1.8×10-5 ,则CH3COO-的水解常数Kh= ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加____,该过程的现象为__________________________________________________。
(2)步骤②加入过量H2O2的目的是___________________________________。
(3)步骤③中反应的离子方程式是__________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、____________、灼烧、______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____mol。
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H=________。

(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是____(填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是___________(填化学式),产生Al(OH)3的化学方程式为_________________。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”),负极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸酐(顺-丁烯二酸肝)![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。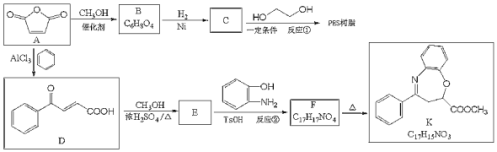
己知:
I.![]() +
+![]()
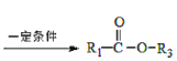 +
+![]()
II.![]()
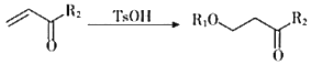
III.![]()
 +H2O(
+H2O(![]() 代表烃基)
代表烃基)
回答下列问题:
(1)C的名称是__________,反应②的反应类型是_______
(Q)B的顺式结构简式为_________,F含氧官能团的结构简式__________。
(3)反应①的化学方程式为_______________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为__________(不考虑立体异构)。
(5)己知:氨基(![]() )与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为
)与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为![]() ,含三个六元环,则L的结构简式为________。
,含三个六元环,则L的结构简式为________。
(6)写出由B合成酒石酸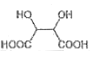 (的合成路线:_______________________。
(的合成路线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面列出了几组物质:A.金刚石与石墨;B.丙烯与环丙烷;C.氕与氘;D.甲烷与戊烷;E.液氨与氨水;F. ![]() 与
与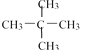 ;G.
;G. 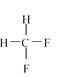 与
与 ,请将物质的合适组号填写在空格上。
,请将物质的合适组号填写在空格上。
①同位素_________
②同素异形体_________
③同系物_________
④同分异构体_________
⑤同一物质_________。
(2)下列物质中:①Ar ②MgBr2 ③Na2O2 ④H2SO4 ⑤CS2 ⑥NH4Br ⑦BaO ⑧RbOH。只存在共价键的是_________ (填序号,下同),只存在离子键的是_________,既存在离子键又存在极性共价键的是_________,既存在离子键又存在非极性共价键的是_________。
(3)异丁烷的一氯代物有_________种,新戊烷的一氯代物有_________种。C3H2Cl6的同分异构体有_________种,C5HCl11的同分异构体有_________种,乙烷和氯气在光照条件下发生取代反应所得产物最多有_________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com