
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/mol·L-1 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)写出醋酸的电离方程式:__________________________。
(2)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________________。
(3)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为____
(4)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___________mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=______________mol/L。
(5)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(6)室温时醋酸的电离常数Ka=1.8×10-5 ,则CH3COO-的水解常数Kh= ____________
【答案】CH3COOH![]() CH3COO- + H+ 当醋酸浓度为0.001 mol/L 时,溶液中的氢离子浓度小于0.001 mol/L c(Na+) = c(CH3COO—)>c(OH—) =c(H+) 10-4 10-4-10-10 bcef 5.6×10-10
CH3COO- + H+ 当醋酸浓度为0.001 mol/L 时,溶液中的氢离子浓度小于0.001 mol/L c(Na+) = c(CH3COO—)>c(OH—) =c(H+) 10-4 10-4-10-10 bcef 5.6×10-10
【解析】
(1)CH3COOH是弱电解质,发生部分电离;
(2)当醋酸浓度为0.001mol/L时,溶液中的氢离子浓度小于0.001mol/L,发生部分电离,为弱电解质;
(3)当pH=7时,c(H+)=c(OH-),溶液存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),中性溶液中氢离子或氢氧根离子浓度较小,则c(CH3COO-)>c(H+),所以有c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(4)溶液中c(H+)=1×10-10mol/L,c(OH-)=1×10-4mol/L,溶液中的电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-4-10-10)mol/L;
(5)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(6)CH3COO-的水解平衡常数Kh═c(CH3COOH)c(OH-)/c(CH3COO-)=Kw/Ka。
(1)CH3COOH是弱电解质,发生部分电离,电离方程式为:CH3COOH![]() CH3COO-+H+,故答案为:CH3COOH
CH3COO-+H+,故答案为:CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(2)若醋酸为强酸,则完全电离。由于是一元酸,0.0100mol/L的醋酸的PH应为2,已知PH为3.38,说明醋酸没有完全电离是弱酸。故答案为:当醋酸浓度为0.001mol/L时,溶液中的氢离子浓度小于0.001mol/L。
(3)当pH=7时,c(H+)=c(OH-),溶液存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),中性溶液中氢离子或氢氧根离子浓度较小,则c(CH3COO-)>c(H+),所以有c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故答案为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)。
(4)0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后恰好完全反应,所得溶液为CH3COONa溶液,溶液的pH=10,溶液中c(H+)=1×10-10mol/L,c(OH-)=1×10-4mol/L,由于CH3COO-的水解促进了水的电离,该混合溶液中由水电离出的c(OH-)等于溶液中的c(OH-),为1×10-4mol/L,溶液中的电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-4-10-10)mol/L,故答案为:10-4,10-4-10-10。
(5)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10molL-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故a错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故b正确;
c.加水稀释至0.010molL-1,促进醋酸的电离,则醋酸的电离程度增大,故c正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故d错误;
e.加入少量镁粉,镁与醋酸反应生成氢气,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故e正确;
f.加入少量0.10molL-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故f正确。
故答案为:bcef。
(6)CH3COO-的水解平衡常数Kh═c(CH3COOH)c(OH-)/c(CH3COO-)=Kw/Ka=1.0×10-14/1.8×10-5=5.×10-10,故答案为:5.6×10-10。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的描述中,正确的是
①钠放入水中后,沉在水下缓缓冒出气体
②Na2CO3和NaHCO3的溶液都可以使无色酚酞试液变红
③氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰
④将某气体通入品红溶液中,红色褪去,说明该气体一定是SO2
⑤向某溶液中加入烧碱溶液,加热后生成使湿润红石蕊试纸变蓝的气体,说明原溶液中有NH4+。
⑥过氧化钠与水反应放出大量热
A. ①③⑥ B. ②④⑤ C. ②⑤⑥ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作现象 | 实验结论 |
A | 像某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含有Br2 |
B | 像某溶液与稀盐酸反应产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液中一定含有CO32- |
C | 加热盛有少量NH4HCO3 固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3呈碱性 |
D | 向久置的Na2SO3 溶液中加入足量BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,沉淀部分溶解 | Na2SO3 部分被氧化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质

(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。

①物质a是__________________(填化学式)。
②T1应控制在______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验SO![]() ,甲、乙、丙、丁四位同学设计了如下四种方案,其中方案最优的是( )
,甲、乙、丙、丁四位同学设计了如下四种方案,其中方案最优的是( )
A. 方案甲:试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
B. 方案乙:试液![]() 无沉淀(也无气泡)
无沉淀(也无气泡)![]() 白色沉淀
白色沉淀
C. 方案丙:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
D. 方案丁:试液![]() 白色沉淀(过滤)
白色沉淀(过滤)![]() 沉淀不溶解
沉淀不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置正确且能达到对应实验目的的是
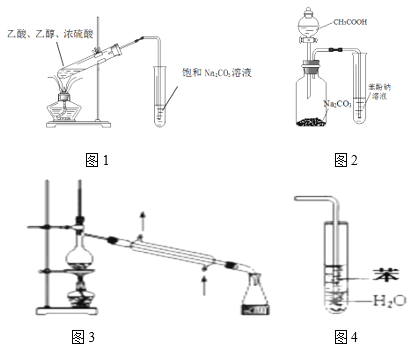
A. 用图1装置制备乙酸乙酯
B. 用图2装置比较乙酸、碳酸、苯酚的酸性强弱
C. 图3常用于分离熔沸点不同的液体混合物
D. 图4可用于吸收HCl气体,并防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:

供选试剂:Na2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是___________。
(2)试剂a是___________(填化学式,下同),试剂b是___________,固体B是___________。
(3)加入试剂a所发生的化学反应方程式为________________________。
(4)该方案能否达到实验目的?___________(填“能”或“不能”)。若不能,应如何改进(若能,此问不用回答)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜的化合物说法正确的是( )
A. 根据铁比铜金属性强,在实际应用中可用FeCl3腐蚀Cu刻制印刷电路板
B. CuSO4溶液与H2S溶液反应的离子方程式为:Cu2++S2-![]() CuS↓
CuS↓
C. 用稀盐酸除去铜锈的离子方程式为CuO+2H+===Cu2++H2O
D. 化学反应:CuO+CO![]() Cu+CO2的实验现象为黑色固体变成红色固体
Cu+CO2的实验现象为黑色固体变成红色固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com