
CO(g)+H2O(g)  ?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
| A.加入催化剂,加快了反应速率,反应的ΔH也随之改变 |
| B.温度降低,正、逆反应速率都减小,反应放出的热量不变 |
| C.恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
| D.改变压强,反应速率发生改变,反应放出的热量不变 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )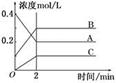
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中,对于可逆反应A+3B 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
| A.若正反应方向ΔH<0,则T1>T2 |
| B.压强增大时,混合气体的平均相对分子质量减小 |
| C.B一定为气体 |
| D.A一定为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应2SO2+O2 2SO3下列判断正确的是
2SO3下列判断正确的是
| A.2 mol SO2和足量的O2反应,必生成2 mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度必为O2浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一固定容积的密闭容器中,可逆反应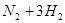
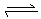
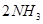 达到平衡的标志是( )。
达到平衡的标志是( )。
A.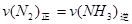 |
B.单位时间内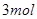 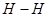 键断裂,同时6mol 键断裂,同时6mol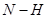 键断裂 键断裂 |
C.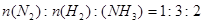 |
| D.反应混合物各组分的物质的量浓度还在改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
水的电离平衡曲线如图所示,下列说法正确的是 
| A.图中五点KW间的关系:B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用平衡移动原理解释的是
| A.钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C.蒸馏水和0.1 mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,可逆反应N2 + 3H2 2NH3达到化学平衡状态,下列说法一定正确的是
2NH3达到化学平衡状态,下列说法一定正确的是
| A.每1 mol N≡N断裂的同时有2 mol N—H生成 |
| B.N2、H2、NH3的浓度之比为1:3:2 |
| C.N2减少的速率和NH3减少的速率之比为1:2 |
D.气体体积为初始体积的 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列选项中的图像所表示的内容与相应反应符合的是(a、b、c、d均大于0)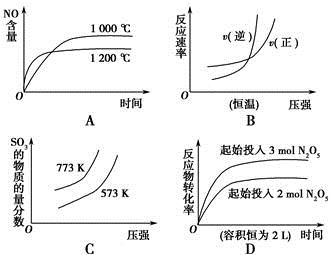
A.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g) ΔH=-b kJ·mol-1 2NH3(g) ΔH=-b kJ·mol-1 |
C.2SO3(g)  2SO2(g)+O2(g) ΔH=+c kJ·mol-1 2SO2(g)+O2(g) ΔH=+c kJ·mol-1 |
D.2N2O5(g)  4NO2(g)+O2(g) ΔH=+d kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com