
【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
![]()
经一段时间后达到平衡,反应过程中测定的部分数据如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/ mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A. 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B. 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L min)
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆
【答案】C
【解析】A.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故乙苯的转化率为![]() ×100%=50%,保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变为50%,故A错误;B.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,故v(乙苯)=
×100%=50%,保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变为50%,故A错误;B.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,故v(乙苯)= 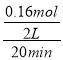 =0.004molL-1min-1,速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004molL-1min-1,故B错误;C.反应中气体的质量不变,但物质的量逐渐增大,若混合气体的平均摩尔质量不再变化,说明气体的物质的量不变,则说明反应已达到平衡状态,故C正确;D.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为
=0.004molL-1min-1,速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004molL-1min-1,故B错误;C.反应中气体的质量不变,但物质的量逐渐增大,若混合气体的平均摩尔质量不再变化,说明气体的物质的量不变,则说明反应已达到平衡状态,故C正确;D.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为![]() =0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数k=
=0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数k=![]() =0.1.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,此时浓度商Qc=
=0.1.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,此时浓度商Qc=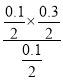 =0.15,大于平衡常数0.1,反应向逆反应进行,故达到平衡前v正<v逆,故D错误;故选C。
=0.15,大于平衡常数0.1,反应向逆反应进行,故达到平衡前v正<v逆,故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。

(1) 该反应的化学方程式为____。
(2) 反应开始至2分钟时,B的平均反应速率为____。
(3) 能说明该反应已达到平衡状态的是______。
A.υ(A)=2υ(B) B.容器内气体密度不变
C.υ逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4) 由图求得平衡时A的转化率为____。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。

①请完成此实验设计,其中:V1=____,V6=____。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
A. 氢氧化钠溶液 B. 氢氧化钡溶液
C. 氨水溶液 D. 澄清的石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A. 盐酸 B. 氨水 C. 烧碱溶液 D. KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金性质的说法中,错误的是( )
A. 合金的硬度一般比其各成分金属的硬度高
B. 合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的的物理性质不同
D. 合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )

A. 该化合物的名称为乙酸乙酯
B. 该化合物既能发生水解反应,又能发生氧化反应
C. 该化合物与Br2的四氯化碳溶液不反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 共价化合物中可能含有离子键
B. Ca2+、K+、Cl﹣、S2﹣四种粒子的离子半径依次减小
C. ![]() Po、
Po、![]() Po、
Po、![]() Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D. 第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O在一定条件下, 可以转化为合成一系列有机化合物、氨的重要原料(CO+H2),这种方法称作甲烷水蒸气重整法制合成气,其能量变化如图:

(1)甲烷水蒸气重整法制合成气的热化学方程式为_______;该反应只有在_____(填“高温”、“低温”或“常温”)才自发进行。
(2)下列有关甲烷水然气重整法制合成气的说法正确的是_____(填字母)。
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO![]() CO2+H2
CO2+H2
(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点____b点,a点CH4的浓度_____b点H2O(g)的浓度,氢气的产率a点_____b点。

(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是_____;当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是_____________________。

(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为_________ 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com